横浜市立大学 木原生物学研究所 杉直也特任助教、丸山大輔准教授らを中心とした研究グループは、青色光(ブルーライト)
*1を照射するという非常に簡便な操作で効率的に花粉管の破裂を誘導できることを発見しました(図1)。
種子を作る多くの植物の精細胞は自ら泳ぐことができず花粉管の内部を輸送されます。精細胞は卵細胞の近くまで到達した花粉管の先端が破裂することで放出され、放出された精細胞は活性化のステップを経て卵細胞との受精が可能となります。生体内においてこの花粉管破裂は厳密に制御されていますがその全容は明らかになっておらず、人為的な花粉管破裂の制御にも技術的な課題が多くありました。本研究では、青色光を照射するという非常に簡便な操作で花粉管破裂を効率的に誘導する方法論を確立しました。効率的な花粉管破裂誘導法の開発により、花粉管破裂直後に素早く起こる精細胞活性化機構の解析への新たな道が開けました。このことは植物独自の重複受精の仕組みの解明に貢献するものです。さらには、花粉管破裂異常が原因で交雑できない種間の雑種形成を通した有用作物開発などへの展開も期待できます。
本研究成果は、植物専門誌「Plant and Cell Physiology」に掲載されました。(2024年3月12日)
研究成果のポイント
・青色光を用いることで人為的に花粉管破裂を効率良く誘導する方法論を確立
・シロイヌナズナに限らず、複数の植物種の花粉管で破裂を誘導できる
・重複受精における精細胞活性化機構の理解に貢献する技術
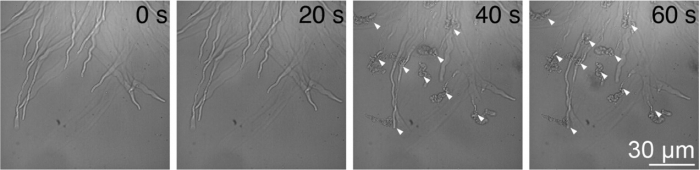
図1 青色光照射による花粉管破裂誘導
野生型シロイヌナズナの花粉管に対して青色光照射を開始してからの継時変化。矢尻は破裂した花粉管を示す。
1分以内に約半数という高い効率で花粉管破裂を誘導できた。
研究背景
穀類など被子植物の種子の形成には2つの精細胞が卵細胞と中央細胞とそれぞれ受精する重複受精が不可欠です。この精細胞の通り道である花粉管は素早い先端生長を示す特殊な細胞であり、めしべ内の細胞がひしめく環境でも細胞間を掻き分けるように力強く素早く伸長する頑健性がある一方で、卵細胞の近くに到着すると破裂して精細胞を放出する鋭敏性を兼ね備えています。杉特任助教らの研究グループは、モデル植物であるシロイヌナズナの花粉管を材料として研究を行う過程で、青色光を照射する条件下では花粉管が効率良く破裂することに気付きました。そこで本研究では、花粉管破裂を制御するメカニズムの解明および人為的な花粉管破裂制御技術の開発に貢献する知見が得られると考え、より詳細な解析を進めることにしました。
研究内容
まず、この青色光照射による花粉管破裂がシロイヌナズナ以外の他の植物種でも見られる現象であるかどうかを調べました。その結果、トレニアやベンサミアナタバコにおいても観察され、他の植物種にも共通した現象であることを確認しました(図2)。さらに、青色光を花粉管の一部にだけ照射する実験により、青色光は花粉管の先端付近に作用することで破裂を誘導していることが明らかとなりました。この花粉管破裂時のカルシウムパターンを明らかにするために、カルシウムセンサーであるGCaMP
*2を発現させた花粉管の観察を行いました。その結果、青色光照射後にカルシウムイオンが流入している様子が観察されました(図3)。このことから、青色光には花粉管に対してカルシウムイオン流入を誘導する作用があり、これにより花粉管破裂が起こることが示唆されました。
図2 シロイヌナズナ以外の植物種における青色光による
花粉管破裂誘導
矢尻は破裂した花粉管を示す。
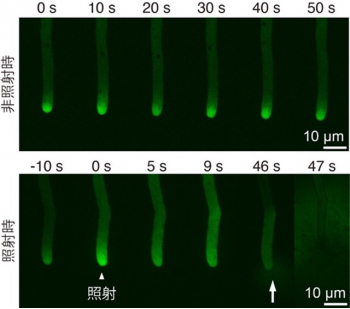
図3 花粉管のカルシウムイメージング
上:青色光非照射時におけるGCaMPの蛍光像。花粉管先端から基部側に向かってカルシウムイオンの濃度勾配が形成されている。
下:青色光照射時におけるGCaMPの蛍光像。青色光照射後、花粉管基部側に向かってカルシウムイオン濃度上昇が観察され、その後花粉管は破裂した(矢印)。
今後の展開
花粉管から放出された精細胞は、さらに精細胞の外側を覆う内部形質膜の崩壊による精細胞膜の露出、そして卵細胞分泌性ペプチドの作用による細胞膜融合因子の活性化を通して受精可能な状態になると考えられています。シロイヌナズナを材料とした研究において重複受精は花粉管破裂後約7分程度で完了する素早い現象であることが示されており(参考文献1)、精細胞の活性化も数分以内には完了すると考えられます。しかし、その反応の素早さゆえに、重複受精完了に至る過程の全容解明が困難でした。花粉管破裂にはメス組織で産生されるペプチドや活性酸素種が関与することが報告されており、これらを添加することによって花粉管破裂を誘導できることは知られていました。しかしながら、顕微鏡観察下におけるこれらの添加には一定以上の顕微操作技術が必要であること、添加した液体によって観察対象が移動してしまうため経時的な観察に不向きであること、破裂効率が低いことなどの問題点がありました。
本研究により煩雑な操作をせずとも任意のタイミングで観察対象のブレを最小限に抑えて人為的に花粉管破裂を誘導することが可能となりました。これにより、内部形質膜の崩壊および細胞膜融合因子の活性化過程についてより時空間的に解像度の高い解析が可能となり、精細胞活性化の全容解明に貢献すると考えられます。また、異なる種間の交雑では花粉管が卵細胞の付近まで伸長するもの花粉管破裂が起こらないために受精に至らず雑種が形成できない場合が知られています。このような組み合わせに対して本研究で明らかになった方法を適応することにより、これまでになかった組み合わせの雑種を得られる可能性があり育種への利用なども考えられます。
研究費
本研究は、JSPS科研費 、ながひさ科学振興財団(G2023-01)および横浜市立大学第5期戦略的研究推進事業「研究開発プロジェクト」の支援を受けて実施されました。
論文情報
タイトル: Blue light irradiation induces pollen tube rupture in various flowering plants.
(日本語訳:青色光照射は様々な植物種において花粉管破裂を誘導する)
著者: 杉 直也、須崎 大地、水多陽子、木下 哲、丸山 大輔
掲載雑誌:Plant and Cell Physiology
DOI:
https://doi.org/10.1093/pcp/pcae018
用語説明
*1 青色光(ブルーライト):ここでは主に、蛍光タンパク質の一種で青緑色蛍光を放つCFP (Cyan Fluorescent Protein) の観察に適した励起光である波長425–445 nmの光を指す。シロイヌナズナの花粉管を材料として研究を行う過程で、RFPやGFPの観察に用いる光よりもCFPの観察に用いる光を照射した時の方が高い確率で花粉管の破裂が起こることに着目した。
*2 GCaMP:緑色蛍光タンパク質(Green Fluorescent protein : GFP)の構造の中にカルモジュリンと呼ばれるカルシウムイオン結合性の配列が組み込まれており、カルシウム濃度に応じて蛍光強度が変化する性質を持つ。これを用いることで細胞内のカルシウム濃度変化を評価することができる。
参考文献
1. Hamamura, Y. et al., (2011) Live-cell imaging reveals the dynamics of two sperm cells during double fertilization in Arabidopsis thaliana. Current Biology 21: 497–502.
https://doi.org/10.1016/j.cub.2011.02.013