概要
理化学研究所(理研)生命機能科学研究センターエピジェネティクス制御研究チーム(研究当時)の梅原崇史チームリーダー(研究当時、現創薬タンパク質解析基盤ユニット上級研究員)、菊地正樹研究員(研究当時、現生命医科学研究センター免疫器官形成研究チーム研究員)、環境資源科学研究センターケミカルゲノミクス研究グループの伊藤昭博客員主管研究員(東京薬科大学生命科学部教授)、横浜市立大学大学院生命医科学研究科構造エピゲノム科学研究室の小沼剛助教らの共同研究グループは、多くのタイプのがん細胞で高発現しているタンパク質GAS41
[1]が、後成遺伝情報
[2](エピジェネティック情報)を担うヒストンH3タンパク質のアセチル化修飾
[3]を認識し、特定の遺伝子の発現を活性化する仕組みを発見しました。
本研究成果により、GAS41が高発現している多種類のがん細胞の増殖を抑える制御分子の合理的な開発が期待されます。
ヒトをはじめとする真核細胞
[4]のゲノムDNAはヌクレオソーム
[5]という構造を形成して凝縮しており、エピゲノム
[2]はどの遺伝子のヌクレオソームをその転写
[6]に先立って解きほぐすかを制御しています。
今回、共同研究グループは構造生物学・生化学・細胞生物学の手法でGAS41の構造と機能を解析しました。その結果、GAS41タンパク質が、ヒストンH3の「N末端
[7]」と「N末端から数えて14番目または27番目のリシン残基
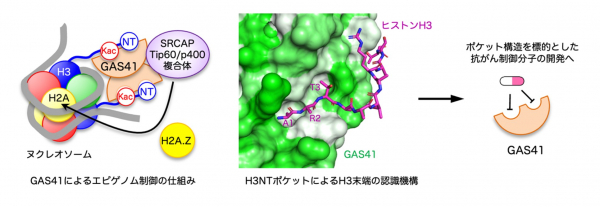
[8]のアセチル化修飾」をそれぞれ異なるポケットを用いて認識し、ヌクレオソームにH2A.Zというヒストンの変種タンパク質の導入を促進することで、特定の遺伝子を転写しやすくする仕組みが明らかになりました。
本研究は、科学雑誌『Proceedings of the National Academy of Sciences(PNAS)』オンライン版(10月16日の週)に掲載されます。
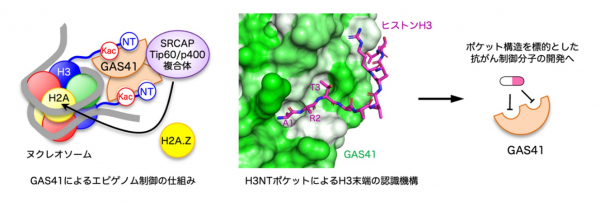 GAS41がエピゲノム修飾の位置を端から数える仕組みの解明
GAS41がエピゲノム修飾の位置を端から数える仕組みの解明
背景
後成遺伝情報はエピゲノムから転写する遺伝子の質と量の制御に関わることが知られています。数多く知られている後成遺伝情報の中でもヒストンのアセチル化修飾は、多細胞生物のそれぞれの細胞種に特異的に発現している遺伝子の転写を活性化する上で重要と考えられています。近年、ヌクレオソーム内部のヒストンにおけるリシン残基のアセチル化がどのような順序で伝播して遺伝子の転写を活性化するかの仕組みや、ヒストンの特定のリシン残基のアセチル化がエピゲノムからの遺伝子転写のどの反応素過程を活性化するかの仕組みなどが示唆されています注1、2)。
ヒストンのアセチル化修飾が遺伝子転写の活性化を引き起こす仕組みには複数の経路があります。重要な制御経路として、アセチル化されたヒストンの種類やリシン残基の位置を見分けて認識する「読み手」タンパク質が関わる経路が知られています。ヒストンのアセチル化修飾に対しては、ブロモドメイン[9]やYEATSドメイン[1]を持つタンパク質が主要な「読み手」タンパク質であり、細胞内でこれらのタンパク質の発現が亢進するとがんや炎症などの疾患につながることが知られてきています。
ブロモドメインがヒストンのアセチル化修飾を認識する仕組みについては解析が進んでおり、特定のブロモドメインを持つタンパク質の機能を選択的に阻害する化合物の開発やそれを利用したがん制御機構の研究が進められてきています注3、4)。その一方、YEATSドメインがヒストンのアセチル化修飾を認識する仕組みについては不明な点が多く、YEATSドメインに対する阻害剤の開発も遅れている状況でした。
そこで共同研究グループは、ヒトに4種類存在するYEATSドメイン含有タンパク質のうち、難治性がんの一種である膠芽腫(こうがしゅ)細胞[10]で遺伝子増幅が見られるGAS41に着目しました。GAS41は、真核生物の種間で保存されたクロマチン[5]の構造を制御するタンパク質複合体の構成成分の一つであり、クロマチンの構造を変化させることで遺伝子の転写を活性化します。GAS41の遺伝子は膠芽腫細胞だけでなく、胃がんや肝がん、直腸がん、すい臓がん、乳がんや肺がんの細胞で過剰発現が見られ、細胞内でGAS41遺伝子の発現を弱めるとこのような発がんを軽減できることが近年知られています。GAS41による発がん活性は、GAS41のYEATSドメインがヒストンのアセチル化修飾を認識することと関連していますが、その認識がどのような仕組みによって担われているのかについては不明な点がありました。そこで本研究では、GAS41がYEATSドメインを介してどのようにヒストンの特定のアセチル化状態を認識して細胞内で機能するのかの仕組みの解明を目指しました。
注1)2023年7月17日プレスリリース「遺伝子発現を制御するエピゲノムの複製と転写」
https://www.riken.jp/press/2023/20230717_1/
注2)2020年11月26日プレスリリース「エピゲノムの制御を受けた転写の方程式」
https://www.riken.jp/press/2020/20201126_1/
注3)2018年8月8日プレスリリース「『がんエピゲノム』を検出する新手法」
https://www.riken.jp/press/2018/20180808_2/
注4)2023年10月3日プレスリリース「遺伝子発現を活性化するスーパーエンハンサーの再定義」
https://www.riken.jp/press/2023/20231003_1/
研究手法と成果
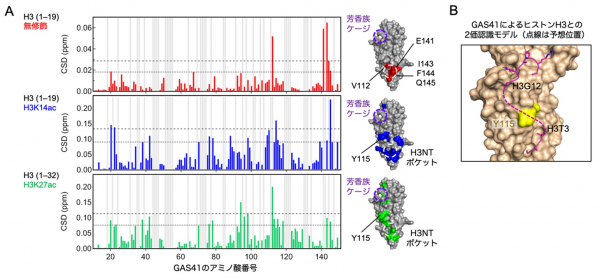
共同研究グループは初めに、GAS41のYEATSドメインがヒストンのどのようなアセチル化状態を認識するのかについて、ヒストンの種類、N末端テイルにおけるアセチル化修飾の位置、N末端テイルの長さを変えて生化学的に比較検討しました。その結果、GAS41のYEATSドメインはヒストンH3のN末端から数えて14番目のリシン残基のアセチル化(K14ac)と最も強く結合すること、さらにその結合にはヒストンH3のN末端1〜6番目までのアミノ酸残基が不可欠なことが分かりました。通常、「読み手」タンパク質は、特定の化学修飾を含むアミノ酸残基とその前後の数カ所の残基のアミノ酸配列を認識します。今回のデータは、GAS41のYEATSドメインがヒストンH3の「N末端」と「K14ac」という離れた2カ所を何らかの方法で認識する仕組みを備えていることを示唆しました。
そこで次に、K14acを含むヒストンH3のN末端テイル領域とGAS41のYEATSドメインとの複合体の結晶をX線で構造解析しました。その結果、リシンアセチル化を「読む」機能を持つGAS41のYEATSドメインは確かにアセチル化したヒストンH3テイルのK14acとその周辺のアミノ酸配列に結合していました(図1、左端のパネル)。この結合は、YEATSドメインが形成する芳香族ケージと呼ばれるポケットによって担われています。
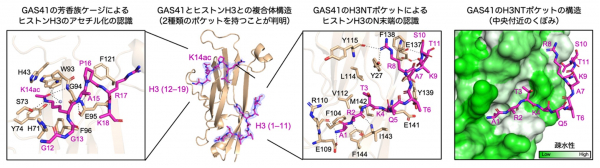 図1 GAS41がヒストンH3のN末端テイルを認識する2種類の仕組み
図1 GAS41がヒストンH3のN末端テイルを認識する2種類の仕組み