横浜市立大学大学院生命医科学研究科 博士後期課程3年の石本直偉士さん、博士研究員 パク・ジェヒョン(Jae-Hyun Park)さんら朴三用教授の研究グループは、同大学院生命医科学研究科 明石知子教授、東北大学大学院薬学研究科の井上飛鳥教授らとの共同研究により、炎症反応に応答して分泌されるタンパク質であるケモカイン
*1の一種インターロイキン8(IL-8、別名CXCL8)とその受容体であるC-X-Cケモカイン受容体1(CXCR1)、Giタンパク質三量体からなるシグナル伝達複合体の立体構造をクライオ電子顕微鏡単粒子解析法
*2により世界で初めて明らかにしました。
本研究成果は、体内での免疫応答のメカニズムへの知見を深めるとともに、がんや炎症反応に対する治療薬の開発に貢献することが期待されます。
本研究成果は、「Nature Communications」に掲載されました。(日本時間2023年7月11日午前0時)
研究成果のポイント
- 炎症に関わるタンパク質であるインターロイキン8とその受容体CXCR1の複合体の立体構造を解明。
- 免疫応答の知見につながるとともに、インターロイキン8はがんの転移にも関わっていることから、がんの治療薬開発への貢献が期待される。
図:研究の概要図
研究背景
生物は外界からの異物に対して自己を守る免疫システムを兼ね備えています。外界から侵入した異物の排除にあたる白血球は遊走
*3によりいち早く異物の排除へと向かいます。中でも白血球の一種である好中球
*4は貪食作用
*5を持ち、細菌や真菌感染などから我々の体を守っています。体内では異物の侵入を知らせるタンパク質としてサイトカイン
*6が放出されており、それらは炎症の原因となります。このサイトカインの一種であるケモカインに属するインターロイキン8(IL-8、別名CXCL8)は、好中球の表面に存在するC-X-Cケモカイン受容体(CXCR1やCXCR2など)と結合することで好中球の遊走が活性化されることが知られています。さらには腫瘍由来のCXCL8は血管新生やがんの転移に関わっています。また、CXCL8の受容体であるC-X-Cケモカイン受容体はGタンパク質共役型受容体(GPCR)
*7の1つであり、薬剤標的としても注目されています。これまでにCXCR2の構造が報告され明らかになっていましたが、CXCR1とCXCL8の複合体構造やCXCR2との構造的違いについては解明に至っていませんでした。
研究内容
本研究グループは、クライオ電子顕微鏡単粒子解析により、CXCL8とその受容体の1つであるCXCR1とGタンパク質の複合体の立体構造を明らかにすることに成功しました。CXCR1はGPCR特有の7本の膜貫通型ヘリックスを形成し、細胞外側ではポケットに対してCXCL8が刺さり込むように結合している状態を観測しました(図1a-b)。さらに、CXCL8は解析の結果、単量体として結合していることが明らかとなりました。これらの結果はCXCR1が単量体優位に結合することを示唆したこれまでの論文を構造学的に支持する結果となりました(図1)。
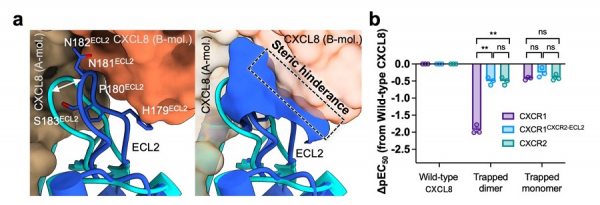
 図1. (a) 今回明らかとなったCXCR1-CXCL8の複合体の全体構造(左:マップ、右:リボンモデル)。(b) CXCL8の結合様式 (c) CXCL8を用いた活性機構。野生型(WT)や単量体変異体(Trapped monomer)と比較して、二量体変異体(Trapped dimer)では活性が低い。
図1. (a) 今回明らかとなったCXCR1-CXCL8の複合体の全体構造(左:マップ、右:リボンモデル)。(b) CXCL8の結合様式 (c) CXCL8を用いた活性機構。野生型(WT)や単量体変異体(Trapped monomer)と比較して、二量体変異体(Trapped dimer)では活性が低い。
●単量体・二量体状態のCXCL8の調製
CXCL8は生体内で単量体と二量体の平衡状態で存在しています。これまでの研究で、受容体であるCXCR1は単量体を優位に結合し、CXCR2では双方に結合することが示唆されてきました。CXCR1におけるCXCL8の結合性を明らかにするために、大腸菌発現系を用いて単量体・二量体の双方となりうる野生型CXCL8(Wild type)を調製しました。さらにアミノ酸変異導入により単量体(Trapped monomer)または二量体(Trapped dimer)のみをとるCXCL8変異体を精製しました。これら調製サンプルの状態をサイズ排除クロマトグラフィー(SEC)
*8と横浜市大・明石知子教授によるエレクトロスプレーイオン化質量分析(ESI-MS)
*9により確認をしました(図2)。以上から、3種類のCXCL8の調製に成功し、これらを利用して構造解析・活性測定を行いました。
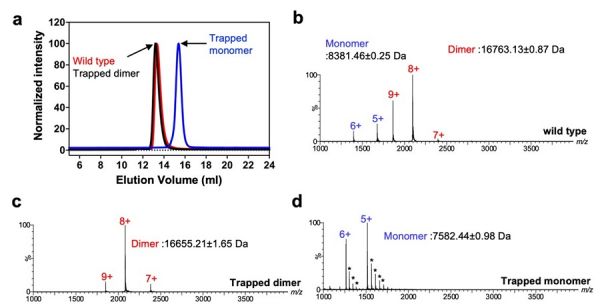 図2. CXCL8の精製結果とESI-MSによる質量分析(a) SECによる各タンパク質の精製結果。高分子量側でWild typeとTrapped dimerのピーク(赤、黒)が観測され、Trapped monomerが低分子量側で確認された(青)。(b-d) ESI-MSによる観測結果。各サンプルの状態は理論値と実測値で概ね一致していた。
図2. CXCL8の精製結果とESI-MSによる質量分析(a) SECによる各タンパク質の精製結果。高分子量側でWild typeとTrapped dimerのピーク(赤、黒)が観測され、Trapped monomerが低分子量側で確認された(青)。(b-d) ESI-MSによる観測結果。各サンプルの状態は理論値と実測値で概ね一致していた。
●CXCR1とCXCL8複合体の構造とリガンドの選択性
クライオ電子顕微鏡単粒子解析により全体構造が3.4 Åを決定しました。CXCR1はN末端のループ領域と細胞外側のポケットの2箇所でCXCL8を認識しており、特に細胞外側に突き刺さるように存在するCXCL8のN末端は塩橋を形成していました(図3a-c)。結合に関与すると考えられるアミノ酸残基について変異体を作製し、東北大学・井上飛鳥教授によるNanoBiT Gタンパク質乖離アッセイ
*10の結果から、それらのアミノ酸残基が相互作用していることを明らかとしました(図3d)。
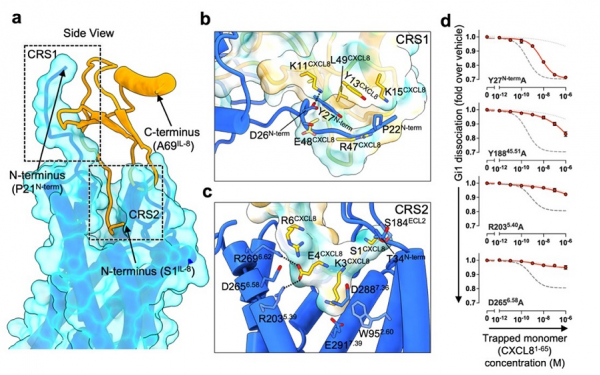 図3. (a-c) CXCR1のCXCL8認識機構 (d) 変異体を用いたNanoBiT Gタンパク質乖離アッセイの結果
図3. (a-c) CXCR1のCXCL8認識機構 (d) 変異体を用いたNanoBiT Gタンパク質乖離アッセイの結果
●CXCL8の選択性
単量体・二量体CXCL8の双方を認識するCXCR2と構造を比較した結果、CXCR1では第二細胞外ループ(ECL2)が最大4 Å外側に動いていることが明らかとなりました。このループは二量体CXCL8と立体障害を起こすことが明らかとなりました(図4a)。さらにCXCR1のECL2をCXCR2のECL2と置き換えたキメラ型CXCR1CXCR2-ECL2を作製し、活性測定を行いました。その結果、このキメラ型受容体は二量体CXCL8でも活性化され、CXCR1においてECL2がCXCL8認識に重要な役割を果たしていることが明らかとなりました(図4b)。これらの結果はこれまでのCXCR1が単量体優位に結合する実験を構造学的に支持する結果となりました。
図4. (a) CXCR1のECL2における立体障害 (b) CXCR1CXCR2-ECL2を用いた活性測定結果。ECL2の置き換えによりTrapped dimerを用いても活性化されるようになったことがわかる。
今後の展開
CXCL8はガンの転移とも密接に関わっており、本研究により明らかとなったCXCR1とCXCL8の複合体の立体構造情報は、今後、がん疾患の新規薬剤の開発や既存薬剤の改良が期待されると共に、これまで困難とされてきたケモカイン受容体特異的な薬剤の開発、Gタンパク質を介したシグナル伝達の機構、免疫応答の機構解明などの知見に重要な役割を果たすことが期待されます。
研究費
本研究は、文部科学省・新学術領域研究「高速分子動画法によるタンパク質非平衡状態構造解析と分子制御への応用」の計画研究(朴三用)、JSPS科研費(基盤B JP21H024449)(朴三用)、日本医療研究開発機構(AMED)「肝炎等克服実用化研究事業」(朴三用)等の支援、また、JST 科学技術イノベーション創出に向けた大学フェローシップ創設事業 JPMJFS2140(石本直偉士)の支援を受け遂行しました。
論文情報
タイトル:Structural basis of CXC chemokine receptor 1 ligand binding and activation
著者:Naito Ishimoto*, Jae-Hyun Park*, Kouki Kawakami, Michiko Tajiri, Kenji Mizutani, Satoko Akashi, Jeremy R.H. Tame, Asuka Inoue, Sam-Yong Park
(*These authors contributed equally to this work)
掲載雑誌:Nature Communications
DOI:
http://doi.org/10.1038/s41467-023-39799-2
用語説明
*1 ケモカイン:サイトカインの一種であり、ケモカイン受容体と結合し、白血球の遊走を誘導するタンパク質。その配列と構造の違いによってCXC、CC、CX3C、XCケモカインと呼ばれる4種類に分けられる。50種類以上のケモカインが存在し、その受容体として23種類が同定されている。
*2 クライオ電子顕微鏡単粒子解析:タンパク質の立体構造を明らかにする手法の一つ。生体分子をマイナス180度近い極低温状態の氷の中に包埋し、その状態で電子顕微鏡により観測する。観測した生体分子の粒子像を大量に撮影し、得られた数十万の粒子像から3次元に再構成することで立体構造を明らかにする手法のこと。
*3 遊走:細胞が生体内を移動すること。こうした機構は創傷の治癒やがんの転移などにも関わっている。
*4 好中球:白血球の一種。血中の循環白血球では最大60%を占めており、体内に病原体、異物の侵入を確認した場合、その組織へ移動し貪食により異物の排除を行う。
*5 貪食作用:食作用(ファゴサイトーシス)とも呼ばれ、自然免疫において重要な機能の一つである。この機能により生体内に外界から侵入した異物は食細胞により取り込まれ除去される。ウイルスなどに感染した初期に起こる機構の一つであり、免疫応答に重要な役割を果たしている。
*6 サイトカイン:免疫細胞をはじめとする細胞から分泌される低分子量のタンパク質の総称。標的細胞に対して結合することで免疫細胞の活性化や機能抑制などの細胞間の情報伝達を担っており、生体内の免疫機構の調整に重要な役割を果たしている。
*7 Gタンパク質共役受容体(G protein-coupled Receptor : GPCR):ヒトゲノム中に約800種類ほど存在している7回膜貫通型の膜タンパク質。リガンドを外界からの刺激として、細胞内ではGタンパク質を介して情報を伝達する役割を担う。医薬品の約3割がGPCRを標的としており、創薬ターゲットとして注目を集めている。
*8 サイズ排除クロマトグラフィー:タンパク質の精製手法の一つ。溶液中の分子サイズに応じでサンプルの分離ができる。分離に用いられる担体には無数の小さな孔が空いており、サイズに応じてカラム内の移動速度が異なり、大きなタンパク質は早く、小さなタンパク質は遅い。そのため、サイズの大きいタンパク質から順に溶出する。
*9 エレクトロスプレーイオン化質量分析:質量分析における測定手法の一つ。大気圧下で測定溶液をイオン化し噴霧することでその質量を測定する。分子量10万程度以下のサンプルに対して測定可能であり、タンパク質などの複雑な混合物でも溶液内での状態を反映した高感度な質量分析が可能である。
*10 NanoBiT Gタンパク質乖離アッセイ:Large BiT(LgBiT, 約18kDa)とSmall BiT(SmBiT, 11残基)と呼ばれる2つのルシフェラーゼの分割断片で構成されており、両者は結合することで発光する。この仕組みを利用して、三量体Gタンパク質のGαサブユニットにLgBiT、GγサブユニットにSmBiTを融合した改変体を評価対象のGPCRと共に培養細胞に発現させる。Gタンパク質の活性化によって両者が乖離するため、減光を検出することで、リガンドに応じた活性を測定することができる手法。
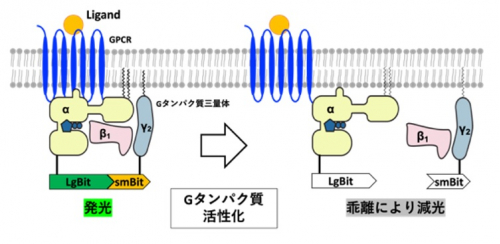 図. NanoBiT Gタンパク質乖離アッセイの原理
図. NanoBiT Gタンパク質乖離アッセイの原理