藤田医科大学国際再生医療センターの佐藤 貴彦講師(医学部解剖学I兼任)率いる研究チームは、微小重力環境下で筋萎縮が誘導される際に、ヒトの筋細胞においてミトコンドリアと小胞体の接合点(MAM)が減少することを明らかにしました。本研究では、ヒト筋細胞およびヒトiPS細胞を用いて、MAM形成に不可欠なMitofusin2(MFN2)遺伝子の機能を解析しました。その結果、ミトコンドリアを含むオルガネラネットワークが破綻した際に、活性型Notchが筋萎縮と関連していることが確認されました。これらの研究成果から、微小重力などが引き起こす様々な筋萎縮に対して、MAMの制御やNotchシグナル経路の抑制が改善効果をもたらす可能性が期待されます。
本研究成果は、eLife Sciences Publications, Ltd(Cambridge,UK)の学術ジャーナル「eLife」のオンライン速報版として2023年12月12日(イギリス時間12月11日)に公開されました。
日本において長寿命社会が実現されつつある中、高齢者の運動機能維持は大きな社会的課題となっています。特に「寝たきり」は高齢者の生活の質を低下させるだけでなく、介護者の負担や社会保障費の増大にもつながっています。この状態の原因の一つに、廃用症候群などの運動器障害が挙げられます、その中でも筋が長期間使われないことで生じる廃用性筋萎縮が重要視されています。この筋萎縮は外部からの力学的負荷(メカノストレス)が不足することが一因と考えられています。実際、筋力トレーニングなどの強制的メカノストレスは筋萎縮の症状を緩和することが知られています。しかし、メカノストレスが筋の恒常性維持にどの程度寄与しているか生命科学的な詳細についてはまだ十分に解明されていません。
宇宙実験によっても筋萎縮が観察され、その際には筋細胞内でミトコンドリアの形態異常などが報告されています。また、ミトコンドリア関連分子の遺伝子変異も筋萎縮が関連していることから、ミトコンドリアは筋萎縮と深く関わっていると考えられます。個体レベルでも、ミトコンドリア機能の変調が筋萎縮を引き起こすことが明確です。このことから、骨格筋内のミトコンドリアが細胞膜下で筋線維を機械的にサポートし合っている可能性が高く、骨格筋におけるメカノセンシング過程においてミトコンドリアが関与するものと考えられています。
研究チームではこれまでに遺伝子改変ヒトiPS細胞からの分化筋細胞作製、人為的な遺伝子リプログラミングによりヒト筋幹細胞の誘導を可能にしてきました(Stem Cell Rep 2019, 2020, Int J. Mol Sci 2019, 2022)。これらの成果を基に、培養可能なヒト筋細胞における標的遺伝子の改変体を作製し、様々な解析が出来るようになってきました。
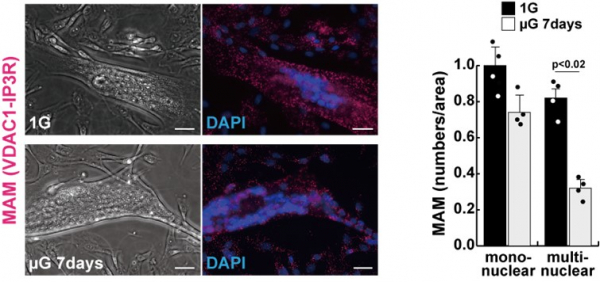
注力して研究してきた誘導型ヒトiPS細胞由来筋細胞および初代培養ヒト筋細胞を用いて、伸展刺激や模擬微小重力環境などのメカノストレスなどによってどのような変化が現れるのか調査した結果、微小重力時にヒト筋細胞中で、ミトコンドリア・小胞体接合点(MAM)が減少することが明らかとなりました(図1)。
図1 微小重力環境で培養したヒト筋細胞ではMAM(図左中の赤色部分)が減少(左下;µG 7days)
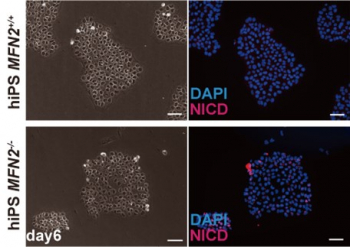
MAMを形成する上で必要不可欠な分子として、MFN2が重要な役割を果たすことが知られています。MFN2はミトコンドリア同士の融合に関与することが示されていますが、この遺伝子の欠損時にはMAMの量が減少するという報告があります。そこでヒトiPS細胞を使用してMFN2を人為的に欠損させた細胞を作成し、その結果、微小重力下での筋細胞同様にMAMの減少が確認されました。さらに解析を進めたところ、Notchシグナル経路が亢進することも明らかとなりました(図2)。
図2 MFN2欠損ヒトiPS細胞中でのNICD(Notch細胞内ドメイン)発現の上昇(図下赤)
Notchシグナル経路の制御がMAMやミトコンドリアに及ぼす影響を調査するため、Notchシグナル経路を抑制するガンマセクレターゼ阻害剤(DAPT)処理を行いました。その結果、ヒトiPS細胞ならびに微小重力時の筋細胞に対してMAMの回復ならびにミトコンドリアの機能改善が示されました。
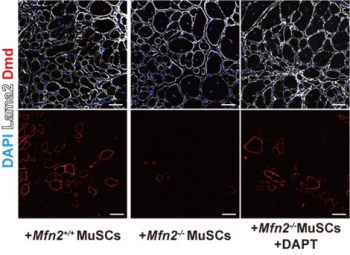
またこれらの結果がマウスの生体内でも同様の効果を示すのかを調査するため、MFN2欠損骨格筋幹細胞を用いた筋再生に焦点を当てました。培養細胞と同様に、マウスの骨格筋幹細胞においても特異的にMFN2を欠損させた場合、MAMの減少と筋再生の遅延が観察されました。さらに、この条件下で再生された筋にDAPT処理を行った結果、MAMの減少が回復し、筋再生が亢進することが示されました(図3右)。
図3 ジストロフィン(DMD)欠損の再生筋中に移植したMFN2欠損筋幹細胞による筋再生への寄与の差(左:野生型筋幹細胞移植、中央:MFN2欠損筋幹細胞移植、右:MFN2欠損筋幹細胞移植後にDAPT処理、図赤色部分:移植幹細胞が発現したDMD)
<今後の展開>
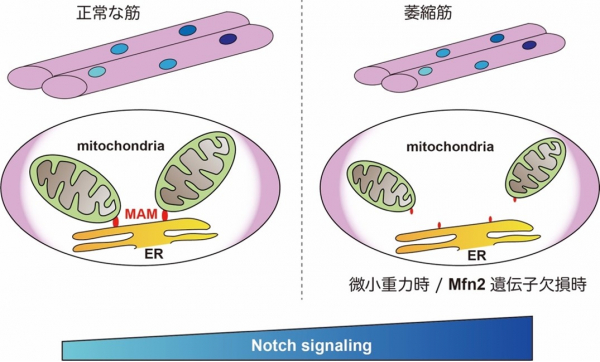
本研究において、筋萎縮時にミトコンドリア融合を司りMAM結成に不可欠なMFN2と、Notchシグナル経路との関係が明らかになりましたが、今後はこれらと相互作用する可能性のある新たな分子機構を解明していきます(図4)。その成果は、筋萎縮の実態解明にとどまらず、リハビリテーションや加齢研究への応用が大いに期待できます。また今回明らかになったMAMおよび筋萎縮時の標的分子となるNotchシグナル経路の制御は薬剤の新規治療ターゲットにつながるものと思われます。
研究チームは、これまで遺伝性筋疾患に対する治療研究に取り組んできましたが、より広汎に引き起こる怪我や加齢による筋萎縮研究にもヒトiPS細胞含めた筋細胞研究が有効になると考えています。また、筋の恒常性維持や発生・再生に関与する力学と生物学との関係を理解することで、様々な組織の再生を含む他の医学領域の発展に寄与したいと考えています。
図4 本研究で明らかとなった筋萎縮時のMAMおよびNotchシグナル経路の概略図
<用語解説>
・ミトコンドリア・小胞体接合点(MAM):
細胞内でミトコンドリアと小胞体の接地部分を指します。これらの細胞内小器官の間で物質の交換や情報伝達が行われる場所で、細胞内の代謝やシグナル伝達に関与します。特に細胞のストレス応答やエネルギー生産などの過程に影響を及ぼし、細胞内で重要な役割を果たしていると考えられています。
・MFN2(Mitofusin2 )遺伝子:
ミトコンドリアの融合に関与するタンパク質をコードする遺伝子です。ミトコンドリアは細胞内のエネルギー産生に重要な役割を果たしており、MFN2はファミリー遺伝子のMFN1と共にミトコンドリアの融合を促進する役割を持っています。近年では、ミトコンドリア同士の融合のみならず、MAM形成のためにも必須であることが明らかとなっています。
・Notchシグナル経路:
細胞間相互作用によって調節される重要なシグナル伝達経路の一つです。Notch受容体と呼ばれるタンパク質が隣接する細胞から送られるシグナルを受け取り、それに応答して細胞内でシグナル伝達が起こります。この経路は、細胞の分化や増殖、生存などに関与しており、特に発生過程や組織形成、細胞の運命決定に重要な役割を果たすことが知られています。
<本研究への支援>
本研究は、AMED-CREST『革新的先端研究開発支援事業(メカノバイオ)』「筋萎縮の病態に迫るミトコンドリアのメカノバイオロジー」(代表研究者・東北大学 東谷篤志)、文部科学省科学研究費補助金『基盤研究C』、中冨健康科学振興財団、堀科学芸術振興財団などの支援により行われました。
<文献情報>
●論文タイトル
The reciprocal regulation between mitochondrial-associated membranes and Notch signaling in skeletal muscle atrophy
●著者
Yurika Ito1#, Mari Yamagata2#, Takuya Yamamoto3, Katsuya Hirasaka6, Takeshi Nikawa7,Takahiko Sato8,9,10*
●所属
1 Faculty of Medical Sciences, Fujita Health University, Toyoake, Japan;
2 Department of Biomedical Engineering, Faculty of Life and Medical Sciences,Doshisha University, Kyotanabe, Japan
3 Center for iPS Cell Research and Application, Kyoto University, Kyoto, Japan
4 Institute for the Advanced Study of Human Biology (WPI-ASHBi), Kyoto University, Kyoto, Kyoto, Japan
5 Medical-risk Avoidance based on iPS Cells Team, RIKEN Center for Advanced Intelligence Project (AIP), Kyoto, Japan
6 Organization for Marine Science and Technology, Nagasaki University Graduate School, Nagasaki, Japan
7 Department of Nutritional Physiology, Institute of Medical Nutrition, Tokushima University Graduate School, 3-18-15 Kuramoto-cho, Tokushima, Japan
8 Department of Ophthalmology, Kyoto Prefectural University of Medicine, Kyoto, Japan
9 Department of Anatomy, Faculty of Medicine, Fujita Health University, Toyoake, Japan
10 International Center for Cell and Gene Therapy, Fujita Health University, Toyoake, Japan. #These authors contributed equally to this work.
●DOI
https://doi.org/10.7554/eLife.89381.2