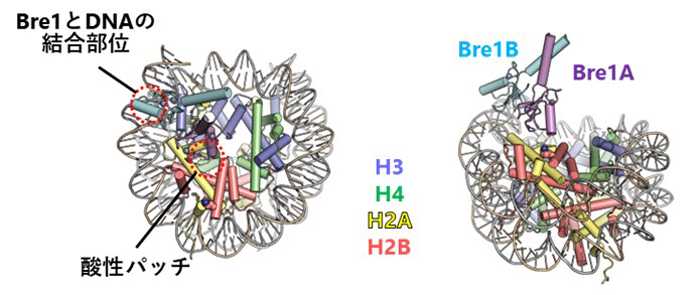
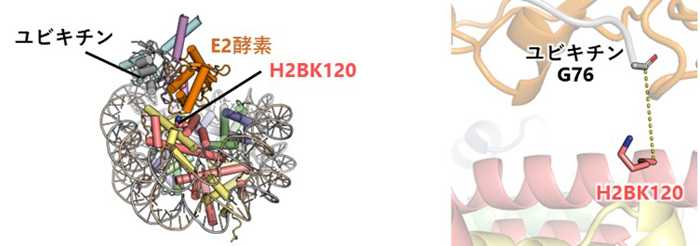
今後の展開
本研究により、H2BK120のユビキチン化レベルの異常が関係するがんの新しい診断法、検査法、および治療法の開発に寄与することが期待されます。また、H2BK120のユビキチン化がヌクレオソームDNAの柔軟性を変える他の現象(ヒストン修飾や他のクロマチン因子の結合など)と互いに影響を及ぼし合う可能性が示唆されました。さらなる研究の進展により、そのような複雑なゲノム機能制御メカニズムの全体像解明が進むと期待されます。
研究費・技術支援
本研究はJSPS科研費(20H05394、21H05161)による支援と創薬等先端技術支援基盤プラットフォーム(BINDS)の技術支援を受けました。
論文情報
タイトル:Structure of the human Bre1 complex bound to the nucleosome
著者:Shuhei Onishi, Kotone Uchiyama, Ko Sato, Chikako Okada, Shunsuke Kobayashi, Keisuke Hamada, Tomohiro Nishizawa, Osamu Nureki, Kazuhiro Ogata, Toru Sengoku
掲載雑誌:Nature Communications
DOI:https://doi.org/10.1038/s41467-024-46910-8
用語説明
*1 クライオ電子顕微鏡:電子線による試料のダメージを抑えるために撮影を極低温条件下で行う電子顕微鏡。近年の技術革新により、生体高分子の立体構造を高分解能で決定できるようになった。
*2 ユビキチン:76個のアミノ酸からなる小さなタンパク質で、標的タンパク質に共有結合(ユビキチン化)することにより、標的タンパク質の機能を制御する。複数のユビキチンが付加されるポリユビキチン化はしばしばタンパク質を分解する目印となる一方で、ヒストンタンパク質は主に1分子のみのユビキチンが付加され、分解とは異なる生命現象が引き起こされる。
*3 ヌクレオソーム:DNAが4種類のヒストンタンパク質(H2A、H2B、H3、H4)に巻き付いた構造体で、真核生物のゲノムが折りたたまれる構造単位。
参考
[1] ヒストンメチル化酵素NSD2は発がん性変異により安全装置が外れ、制御不能になる
https://www.yokohama-cu.ac.jp/news/2021/202111sengoku_nc.html