横浜市立大学 清水健太郎客員教授(チューリッヒ大学教授兼任)らの研究グループは、自家受精する植物が持つ遺伝子の変異を実験的に修復して、自家受精を防ぐ祖先植物のメカニズムを回復することに成功しました。
異なる2種間の雑種由来の倍数体植物では他家受精から自家受精への進化が頻繁に見られることが知られていましたが、そのメカニズムは謎に包まれていました(図1左)。そこで、日本を中心に分布する倍数体植物ミヤマハタザオと、牧野富太郎博士が命名したことでも知られる亜種タチスズシロソウをモデル植物
*1として、ゲノム解析と遺伝子導入実験をおこないました。その結果、他家受精植物では低分子RNAを介して片親ゲノム上にある自家受精拒絶システムが抑制されており、遺伝子が1つ変異しただけで自家受精が可能になることを明らかにしました(図1右)。この研究により、自家受精と他家受精のバランスを人為的に調節できる可能性が示され、これまで困難であった植物種の組み合わせでの交配が可能になるなど栽培植物の育種への貢献が期待されます。
本研究成果は、国際科学雑誌「Nature Communications」に掲載されます。(日本時間2023年11月29日19時)
研究成果のポイント
・自家受精の進化は、チャールズ・ダーウィンの先駆的研究以来、とくに雑種由来の倍数体の植物に
多いことが知られていたが、そのメカニズムには謎が多かった。
・倍数体種ミヤマハタザオの自家不和合性遺伝子SCR/SP11の変異を修復することにより、進化を逆流
させて、祖先の自家不和合性を復元することに成功した。
・牧野富太郎博士が命名した亜種タチスズシロソウの実験とあわせ、低分子RNAが倍数体種の自家受精
の進化を促進した可能性を示した。
・今回の発見を栽培植物に応用すれば、従来困難だった植物種の交配が可能になり、育種への貢献が期待
できる。
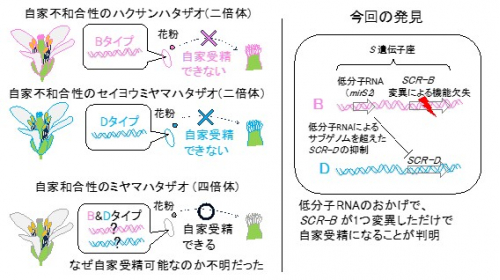
図1 左:倍数体の自家受精の進化の謎。種間交雑に由来する倍数体種では、自家受精を防ぐ鍵と鍵穴のシステムも倍加するので、自家受精に進化する確率はより低くなると考えられていた。右:今回、低分子RNAが片親ゲノム上のSCR-D遺伝子の発現を抑えていることがわかり、SCR-B遺伝子にだけ変異が生じれば自家受精が可能になることを明らかにした。
研究背景
生物が生殖して子供を残す方法はさまざまです。多くの植物では1つの花の中で卵細胞とともに花粉に含まれる精細胞がつくられますが、自家不和合性とよばれる自己認識メカニズムによって同じ個体由来の卵細胞と精細胞の受精を防いでいます(他家受精)。対照的に、自家不和合性をもたず、1個体で卵細胞と精細胞の受精が可能である植物も存在します(自家受精)。チャールズ・ダーウィンは、なぜ自家受精する生物がいるのかに興味を持ち、様々な植物を用いて自家受精実験を行ってその長所と短所を研究しました。実験の結果、自家受精の短所として、近親交配による生育や繁殖の低下がみられました。しかし、数世代のうちにそうした有害な効果が取り除かれ、非常に生育の良い個体が、稀に現れうることを発見しました。そこで、ダーウィンは1876年の著書「植物の受精」の中で、環境変動などによって交配相手が少ない場合には、自家受精が有利であるため進化が起こりうる、という仮説を提唱しました。
植物種の約1/3を占める倍数体種では自家受精が多くみられます。しかし、その進化メカニズムは長く謎に包まれていました。ヒトを含めた二倍体種は母親(卵)と父親(精子)にそれぞれ由来する2セットの染色体DNA (ゲノム)を持ちますが、倍数体種では、種間交配などによってゲノムが重複して3セット以上に増加しています。セイヨウアブラナ(四倍体、4セット)やコムギ(六倍体、6セット)など有用植物に倍数体種が多いことが知られています。20世紀半ばに植物進化学に多大な貢献をしたレジャード・ステビンスは、植物倍数体種について次のような2つの矛盾した点を指摘しました。一方で、倍数体種では、自家受精の進化が促進されている。しかし一方で、倍数体種は遺伝子が増加して重複したために、突然変異の効果があらわれにくく、進化しづらいはずである(図1左)、と。ではどんな分子メカニズムによって倍数体種に自家受精が多く進化したのでしょうか?
チューリッヒ大学の清水研究室では、自家受精をするミヤマハタザオとその亜種であるタチスズシロソウ(牧野富太郎博士が命名)が、自家不和合性である2つの種由来の倍数体であることを約20年前に発見しました(図2)。それ以来、遺伝子導入を可能にするなど、新規のモデル倍数体植物として利用できる基盤を整え、ついに本研究で倍数体種が自家受精に進化したメカニズムを明らかにしました。
図2:牧野富太郎博士が命名したタチスズシロソウのタイプ標本(東京都立大学牧野標本館所蔵)。川崎光次郎が三重県で採集した標本に基づき、1913年に牧野富太郎がArabis kawasakiana Makinoと命名した。標本ラベルに四日市海岸などの記述が読み取れる。その後、清水客員教授らの研究により、シロイヌナズナ属に属するミヤマハタザオに近縁であることがわかったため、2005年にArabidopsis kamchatica subsp. kawasakiana (Makino) K. Shimizu & Kudohと学名が組み替えられた。海岸や湖岸の環境変化により絶滅が危惧されている。
研究内容
ミヤマハタザオが属するアブラナ科の自家不和合性は、オス特異性決定遺伝子
SCR/SP11(以下
SCR)と、メス特異性決定遺伝子
SRKによって制御されており、両者はそれぞれ鍵と鍵穴のような役割をもちます。倍数体種ミヤマハタザオには、親になった二倍体種の片親のハクサンハタザオに由来するS遺伝子座(
S-B)と、もう片親の二倍体種セイヨウミヤマハタザオに由来する
S遺伝子座(
S-D)の2つが存在します。同じ遺伝子座由来の両遺伝子が発現して鍵と鍵穴が揃うと、自家不和合性となり自家受粉が成功しない仕組みです。つまり、ミヤマハタザオが自家受精するためには、
S-Bと
S-Dの両方が機能しなくなるのが条件となります。DNA配列を詳細に解析すると、メス側の
SRK遺伝子(
SRK-B,
SRK-D)はどちらも変異を持たず、鍵穴としての機能を保っていることが示されました。しかし、オス側の2つのSCR遺伝子(
SCR-B,
SCR-D)では、前者は3,960塩基対の挿入配列を持ち、後者は遺伝子全体が欠失しているため、明らかに鍵としての機能は失われており、自家不和合性が失われて自家受精する原因となっていることが示唆されました。
そこで、これらの変異を人工的に修復することで、不和合性を復活させられるかどうか実験を行いました。ミヤマハタザオがもつ
SCR-Bの3,960塩基対の挿入配列を取り除いた配列をミヤマハタザオに導入したところ、祖先のもっていた自家不和合性を復活させることができました(図3)。この進化逆流実験により、
SCR遺伝子に起きた変異が自家受精の進化に貢献したことが示されました。
対照的に、セイヨウミヤマハタザオの
SCR遺伝子(
SCR-D)をミヤマハタザオに復元してみたところ、予想に反して自家不和合性を復活させることはできませんでした。これは何を意味するのでしょうか?ここで、S遺伝子座に存在する低分子RNAに注目しました(Tarutani et al. 2010)。ハクサンハタザオ由来の
S-B遺伝子座からは、24塩基の低分子RNA(
mirS2)がつくられます。こうした低分子RNAは、二倍体種の対立遺伝子の間で、
SCR遺伝子の制御領域に結合してDNAをメチル化し、エピジェネティックに遺伝子発現を抑制します(図1右)。
SCR-Dを復元しても自家不和合性を復活させられなかったのは、親種の一方であるハクサンハタザオ由来の
S-B遺伝子座からのmirS2が、もう一方の親種セイヨウミヤマハタザオ由来の
SCR-Dの発現を抑制するためであることがわかりました。つまり、これは倍数体種の持つ2つの親種に由来する2つのゲノムの間で低分子RNAの制御が成立することを証明するものです。
さらに、牧野富太郎博士が命名した亜種タチスズシロソウでは、
mirS2がおそらく最近になって欠損したというユニークな特徴が見つかりました。そこで、タチスズシロソウにセイヨウミヤマハタザオの
SCR-D遺伝子を導入すると自家不和合性が回復できました。つまり、導入したSCR-D遺伝子自体は鍵としての機能自体は備えているが、ミヤマハタザオでは低分子RNA(
mirS2)による発現調整によってSCR遺伝子が機能しなくなっていることが確認できました(図1右)。
ここまでの遺伝学的な結果をまとめると、倍数体種ミヤマハタザオの
SCR-B への3,960塩基対の挿入変異が自家受精をもたらしたことがわかりました。他方、
SCR-Dは低分子RNAによって抑制されているので変異があってもなくても自家受精に変化はありません。ステビンスは、倍数体は遺伝子重複のために変異の効果が出にくくなるはずなのに頻繁に自家受精への進化が見られる、という矛盾を指摘しましたが、両親種由来の2つのゲノム間の低分子RNAの作用のおかげで片方のゲノムの変異だけで自家受精への進化が実現したのです。このことは、倍数体種でも自家受精が頻繁に見られることと辻褄が合います。
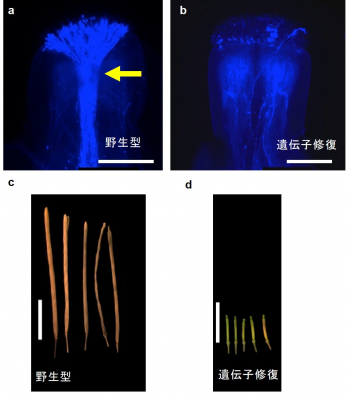
図3:遺伝子修復による自家不和合性の回復。野生型植物では、自家受粉した際に花粉管の束(黄色矢印)が伸長し(a)、受精後に種子の入ったさやが伸長する(c)。一方、SCR-D遺伝子の変異を修復したところ、祖先が持っていた自家不和合性が回復して、花粉管伸長が阻害された(b)。その結果、自家受粉では種子がほとんど生産されなくなった(d)。a, b: 蛍光顕微鏡による花粉管の写真。スケールバーは0.25 mm。c,d: スケールバーは10 mm。
今後の展開
自家受精と他家受精のバランスは、野生生物の保全の観点から重要であるだけでなく、栽培植物でも重要です。栽培植物では、自家受精は収量の増加など有用形質の維持のための育種に役立つ一方、ハイブリッド育種では自家不和合性が必要になります。本研究のように、人為的に自家受精と他家受精のメカニズムを制御することで、育種を促進できることが期待されます。
チャールズ・ダーウィンは自家受精が有利になる場合があるという仮説を1876年に提唱しました。この仮説に、精細胞を持つ花粉の方が卵細胞よりも数が多いという性の非対称性を組み合わせて、メス特異性遺伝子
SRKよりもオス特異性遺伝子
SCRの変異の方が自家受精の進化に貢献しやすいのでは、という理論仮説が提唱されていました。著者たちは2010年に二倍体種シロイヌナズナの変異がこの仮説の予測通り
SCRに起きたことを示し(Tsuchimatsu et al. 2010)、今回さらに倍数体種ミヤマハタザオでも同様にSCRに起きたことを示したことから、複数の種でこの理論仮説を裏付ける結果を得ることができました。また、こうした遺伝解析結果は、新種誕生などによって交配相手が少ない場合には自家受精が有利なこともあるというダーウィンの仮説を支持します。本研究は倍数体種の自家受精という形質に限らず、今後多くの種の様々な形質の研究に展開される可能性があるとともに、これまで困難であった植物種の組み合わせでの交配が可能になることが予想され、栽培作物への応用が期待できます。
研究費
本研究は、文部科学省科研費学術変革領域研究(A)「挑戦的両性花原理」、科学技術振興機構(JST)戦略的創造研究推進事業JPMJCR16O3 (CREST「環境変動に対する植物の頑健性の解明と応用に向けた基盤技術の創出」)、JSPS科研費22K21352(国際先導研究「植物生殖の鍵分子ネットワーク」)、スイス科学財団、チューリッヒ大学学内重点領域「進行中の進化」、チューリッヒ大学・東京大学・京都大学協力プログラムなどの支援を受けて実施されました。
論文情報
タイトル: Dominance in self-compatibility between subgenomes of allopolyploid Arabidopsis kamchatica shown by transgenic restoration of self-incompatibility
著者: Chow-Lih Yew, Takashi Tsuchimatsu, Rie Shimizu-Inatsugi, Shinsuke Yasuda, Masaomi Hatakeyama, Hiroyuki Kakui, Takuma Ohta, Keita Suwabe, Masao Watanabe, Seiji Takayama & Kentaro K. Shimizu
掲載雑誌: Nature Communications
DOI:
https://doi.org/10.1038/s41467-023-43275-2
用語説明
*1 モデル倍数体植物ミヤマハタザオ・タチスズシロソウ
倍数体は野生種・栽培種ともに重要でありながら、これまでの世界の植物遺伝子研究はアブラナ科シロイヌナズナなど2倍体種をモデル生物として行われてきた。それは、倍数体種のゲノムDNAが複雑であるために、重要であっても研究が難しかったからである。
ミヤマハタザオとその亜種タチスズシロソウは、2つの種ハクサンハタザオとセイヨウミヤマハタザオが種間交配し融合してできた倍数体種。両親の二倍体種が他家受精をするのに対して、ミヤマハタザオは倍数体種の典型で、自家不和合性を失って自家受精をする。台湾から日本、朝鮮半島、極東ロシアから北米まで広く分布し、遺伝的多様性の中心が日本にある。とくに、NHK朝ドラ「らんまん」のモデルになった牧野富太郎博士によって、1913年に海岸・湖岸に分布する低地型の亜種タチスズシロソウの学名が命名された。さらに、世界中の植物学者が研究してきたモデル生物シロイヌナズナに近縁であるために、その遺伝子・ゲノム・実験技術などを容易に応用することができるため、倍数体種のモデル植物としても注目されている。
参考文献など
[1]Takashi Tsuchimatsu, Keita Suwabe, Rie Shimizu-Inatsugi, Sachiyo Isokawa, Pavlos Pavlidis, Thomas Städler, Go Suzuki, Seiji Takayama, Masao Watanabe, Kentaro K Shimizu. Evolution of self-compatibility in Arabidopsis by a mutation in the male specificity gene. Nature 464:1342-6, 2010. doi: 10.1038/nature08927.
[2]Yoshiaki Tarutani, Hiroshi Shiba, Megumi Iwano, Tomohiro Kakizaki, Go Suzuki, Masao Watanabe, Akira Isogai, Seiji Takayama. Trans-acting small RNA determines dominance relationships in Brassica self-incompatibility. Nature 466:983-6, 2010. doi: 10.1038/nature09308.
[3]チャールズ・ダーウィン著、矢原徹一訳(原書1876、訳2000)植物の受精(文一総合出版)ISBN978-4-8299-0123-6.