横浜市立大学 医学部 肝胆膵消化器病学の日暮琢磨講師、中島淳教授らの研究グループは、協同乳業株式会社(本社:東京・中央区/社長:宮﨑 幹生)の松本光晴主幹研究員、理化学研究所の服部正平客員主管研究員、須田亙チームリーダーらとの共同研究で、大腸がんの増悪化に関与しているFusobacterium nucleatum(フソバクテリウム ヌクレアタム,以下F. nucleatum)に関する菌株*1レベルでの研究を全ゲノム解析により大幅に進展させました。さらに、生きた菌を分離・培養しなくても、凍結保管していた大腸がん組織や唾液検体中に存在するF. nucleatumを菌株レベルで検出する新たな手法(ジェノタイピング法)を開発したことで、大腸がんの予防などの研究への貢献が期待されます。
本研究成果は、American Society for Microbiology(アメリカ微生物学会)の発行する学術誌「Microbiology Spectrum」に2023年10月11日にオンライン公開されました。
研究成果のポイント
- 先行研究にて、口腔内のF. nucleatumと同一菌株が大腸がん組織から検出されることを
発見[1]
- 熟練した分離・培養スキルに加え、時間およびコスト面でも課題があったが、
CRISPR-Casシステム*2に着目し菌株レベルで識別する方法を確立
- 大腸がんの予防や再発防止などの研究に飛躍的な進歩をもたらすことが期待される
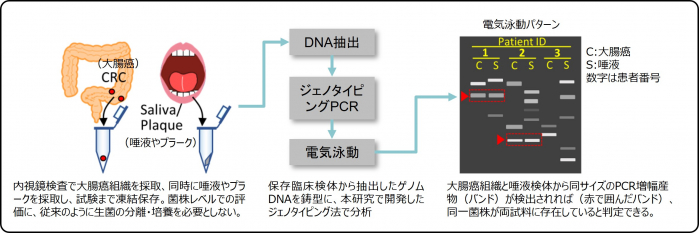
図:開発した技術の概要(論文の一部を説明用に改変)
研究背景
「がんの統計2023」(公益財団法人がん研究振興財団)によると、大腸がんの死亡数は男女ともに増加傾向が続いており、2022年の大腸がん死亡数予測は女性で1位、男性で2位と高く、喫緊の対策が必要となっています。F. nucleatumは、歯周病の原因菌の一つとされるヒトの口腔内常在菌として知られていましたが、この10年間で大腸がん組織から高頻度で検出され、大腸がんの増悪化に関与することが明らかになってきました。当研究グループは先の研究で、大腸がん組織と唾液からF. nucleatumを分離し、AP-PCR*3で解析しました。大腸がんにF. nucleatumを保有している患者の75%で、大腸がん組織と口腔内に同一菌株のF. nucleatumが存在することを強く示唆するデータを得て、口腔内F. nucleatumが大腸がんの増悪化に関連する可能性と、この関連性の解明には種レベルより細かい菌株レベルでの解析が重要であることを報告しました(Gut 68:1335-1337, 2019)[2]。しかしながら、菌株レベルの研究には、F. nucleatumを分離・培養して各分離株のゲノムを個別に解析する必要があり、熟練した分離・培養スキルに加え、時間およびコスト面の問題もあることから、汎用するには多くの課題がありました。本研究では、これらの課題を解決し、正確かつ簡便に大腸がん患者の検体からF. nucleatumを菌株レベルで識別する方法の開発を目指しました。具体的には、F. nucleatumを含む約半数の細菌が保有する免疫機構であるCRISPR-Casシステムに着目し、過去に感染を受けたファージ*4の遺伝子断片が保存されている遺伝子領域を標的としてPCR増幅し、菌株毎の感染歴の違いを増幅されたDNA断片長の違いとして検出することで、菌株を識別する手法(ジェノタイピング法)の確立を目指しました。
研究内容
本研究では、F. nucleatumが保有するCRISPR-Casシステムの探索から始めました。研究開始当初に全ゲノム情報が登録されていたF. nucleatumおよび我々が分離した菌株の合計26菌株を用いて調べた結果、4タイプのCRISPR-Casシステムを保有していることがわかりました(タイプI-B1、タイプI-B2、タイプII-A、タイプIII-A)。
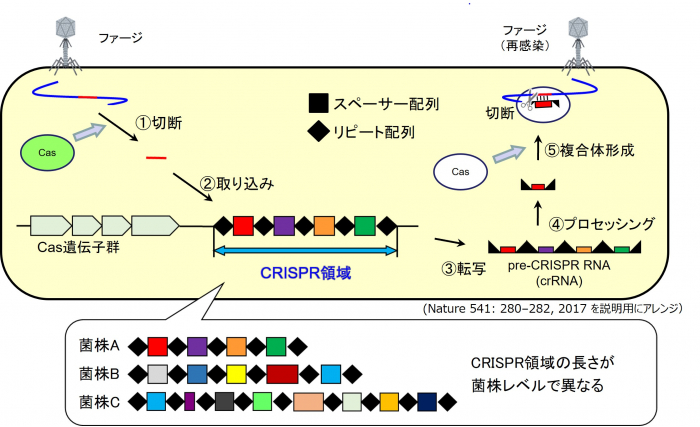
次に、CRISPR-Casシステムの中で、細菌の免疫機構に関連する過去に感染を受けたファージのDNA等の断片配列が挿入されているCRISPR関連領域[繰り返し配列(リピート配列)とその間に挿入されている感染ファージのDNA断片(スペーサー配列)の繰り返し(図1)]を増幅するプライマーおよびPCR条件を4タイプそれぞれに構築しました( F. nucleatum菌株識別ジェノタイピング法)。
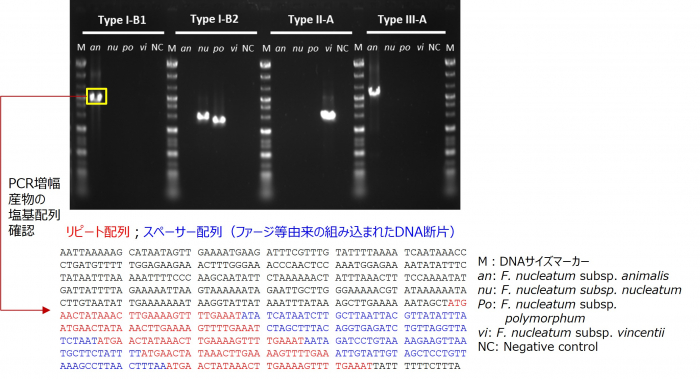
完成したF. nucleatum菌株識別ジェノタイピング法(以降「本ジェノタイピング法」という)を用いたF. nucleatumの各亜種の基準株の解析例を図2に示します。各々のCRISPR関連領域で増幅バンドが検出された菌株はそのCRISPR関連領域を保有していることを示しています。この増幅物の塩基配列を解読したところ、リピート配列とその間のスペーサー配列の繰り返しが確認でき、本手法で狙い通りCRISPR関連領域が増幅できていることが証明できました。
図 1:CRISPR-Cas システムを利用した F. nucleatum 菌株識別ジェノタイピング法の標的 CRISPR-Cas システムは以下のような細菌等の獲得免疫系で、CRISPR 近傍に位置する Cas 遺伝子群から 産生される Cas タンパク質が関与する。①菌体内に侵入したファージ等の DNA を、Cas タンパク質が切 断し、②CRISPR の繰り返し配列間にあるスペーサー部分に取り込み、その遺伝子の侵入を記録する。その 後、同じ遺伝子が侵入すると、③CRISPR 領域が転写され pre-CRISPR RNA(crRNA)が生成され、④それ がプロセッシングを受けて crRNA になる。⑤その後、Cas タンパク質と複合体を形成した crRNA が、自 身の配列と相同性を示す外来 DNA を捉え、切除除去する。本ジェノタイピング法は、②の過程で、菌株毎 にファージの感染履歴(DNA 断片の取り込み履歴)が異なるため、CRISPR 領域の長さが異なることを利 用する。すなわち、CRISPR 領域を挟む位置にプライマーを設計し、PCR の増幅産物(CRISPR 関連領域) のサイズ比較することで、菌株の違いを見極めることができる。
図 2:本研究で構築した F. nucleatum 菌株識別ジェノタイピング法を用いた F. nucleatum 基準株(4 亜種) の解析例
各 CRISPR 関連領域で増幅バンドが検出された菌株は、その CRISPR 関連領域を保有することを示す。 増副産物(黄色線で囲んだバンド)の塩基配列を解読した結果、リピート配列(赤文字)とその間のスペー サー配列(青文字)の繰り返しが確認でき、CRISPR 関連領域を正確に増幅できていることが証明できた。 本リリースではデータは示さないが、他の増幅産物でも同様に確認できた。
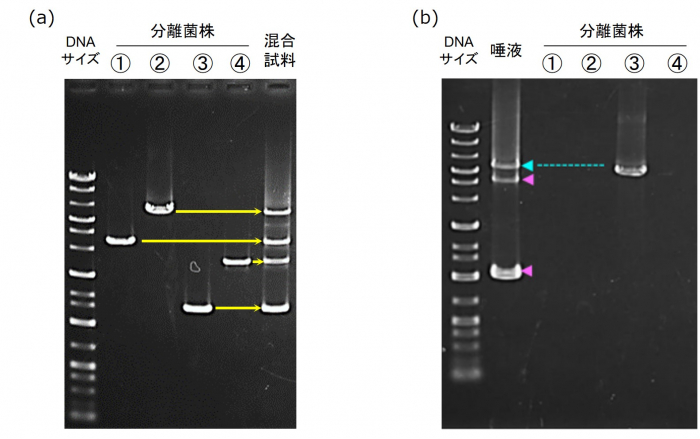
また、複数の菌株が混合している検体において、各菌株が識別できるのかを確認するため に、菌株を人為的に混合した複数菌株由来の試料を解析した結果、明瞭に別サイズの PCR 増幅物(バンド)が得られ、各菌株を識別 s することができました(図 3a)。さらに、唾液 ゲノム DNA 試料とその唾液試料から分離された菌株を比較したところ、分離菌株と同サイ ズの PCR 増幅物(バンド)が確認されると共に、唾液試料からは別のサイズの PCR 増幅物 (バンド)も検出されました(図 3b)。これは、培養法では分離し切れなかった
F. nucleatum 菌株が、唾液中に存在していることを示しています。すなわち、試料中の
F. nucleatum 菌株 検出力は、本ジェノタイピング法の方が培養法よりも高いことを示しています。
図3:分離菌株の混合試料および唾液試料とその分離菌株を本ジェノタイピング法で解析した結果の一例(タイプI-B1を抜粋)
(a) 同じCRISPRタイプを保有する分離菌株を等量ずつ混合した試料の本ジェノタイピング法での分析結果。混合した各菌株由来
のPCR増幅物(バンド)が明瞭に分かれて検出された。
(b) 唾液試料およびその唾液由来分離菌株を本ジェノタイピング法で解析した結果。分離菌株と同サイズのバンドが得られたこと
(青色矢印)に加え、培養法では分離し切れなかったF. nucleatum菌株のバンド(ピンク色)が検出された。
(a)と(b)の分離菌株は異なる。
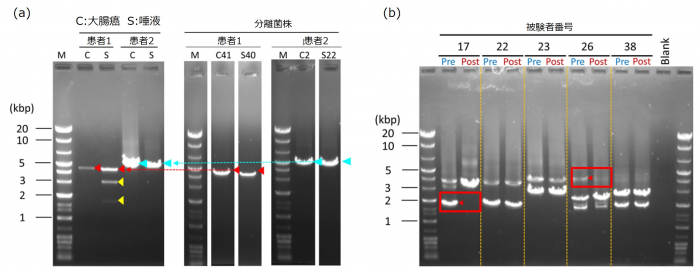
臨床研究への応用を想定して、培養法で同一菌株が検出された大腸がん組織と唾液の凍 結検体および分離菌株を本法で解析しました。その結果、大腸がんと唾液の両検体から、分 離された菌株と同じサイズの PCR 産物(バンド)が検出され、本ジェノタイピング法は、 凍結臨床検体でも有用であることが確認できました(図 4a)。そこで、検査等の応用研究を 見据えて、口腔内に存在する
F. nucleatum の継時的変化を菌株レベルで調べる実験を行い ました。歯周病を発症している大腸腺腫患者の唾液を対象に、歯科医による口腔ケアの影響 を本ジェノタイピング法で調べました。その結果、一部の患者では、口腔内に棲息していた 複数の
F. nucleatum 菌株の中の一部が、口腔内ケアにより検出限界以下になることが観察 されました(図 4b) 。
図 4:大腸癌患者および歯周病と大腸腺腫の併発患者由来の試料での本ジェノタイピング法の解析結果
(a)凍結保存していた大腸癌組織と唾液および分離菌株の本ジェノタイピング法での解析結果。大腸癌 組織と唾液の両方から分離菌株
と同じサイズのバンド(赤または水色の矢印)が検出された。さらに、唾 液中にはそれら以外の菌株(黄色矢印)が存在することも
検出された。C41,S40, C2, S22 は分離菌株名を 示す。
(b)歯周病と大腸腺腫を併発している患者の口腔内ケアによる唾液中 F. nucleatum 菌株変動。一部の患 者で一部の菌株が口腔ケア
により変動することが捉えられた(赤四角)。Pre:処置前;Post:処置後
これらの結果は、本ジェノタイピング法が、大腸がんに定着し増悪化に関与していると推測される口腔内
F. nucleatum菌株の存在を明らかにしたり、その菌株の動態をモニターすることで、大腸がん治療後の再発予防などに役立つことを示唆しています。さらに、同一菌株と同定された大腸がん患者のがん組織と唾液から分離した
F. nucleatum菌株ペアをそれぞれ全ゲノム解析し、一塩基変異(Single Nucleotide Variant)の割合を調べました。その結果、同一菌株ペア間の一塩基変異の割合は0.00036%–0.0038%で、別菌株間の1.228%–3.159%より大幅に少ない結果が得られました。この結果は、少なくとも一部の大腸がん患者は、口腔内と大腸がんに同一菌株由来の
F. nucleatumが定着していること、すなわち、口腔内の一部の
F. nucleatumが大腸がんの増悪化に関与していることを示しています。
さらに、同一菌株と同定された大腸がん患者のがん組織と唾液から分離した
F. nucleatum菌株ペアをそれぞれ全ゲノム解析し、一塩基変異(Single Nucleotide Variant)の割合を調べました。その結果、同一菌株ペア間の一塩基変異の割合は0.00036%–0.0038%で、別菌株間の1.228%–3.159%より大幅に少ない結果が得られました。この結果は、少なくとも一部の大腸がん患者は、口腔内と大腸がんに同一菌株由来の
F. nucleatumが定着していること、すなわち、口腔内の一部の
F. nucleatumが大腸がんの増悪化に関与していることを示しています。
今後の展開
本研究グループでは、この手法を用いて多くの大腸がん症例を調査し、また分離菌株のゲノム情報を解析する予定です。細菌は菌株毎に特性や悪性度が大きく異なることが知られており、口腔内由来
F. nucleatumの病態解明、特に大腸がん増悪化と関連を持つ菌株の同定やその機能解析などを進めていく予定です。それにより、新しい大腸がんの予防法への糸口となることが期待されます。
研究費
本研究は、科学研究費助成事業科研費(18K07950,19K18981,23K17454)、横浜医学振興財団がん研究助成事業の支援を受けて実施されました。
論文情報
タイトル:
Strain-level detection of Fusobacterium nucleatum in colorectal cancer specimens by targeting the CRISPR–Cas region.
著者 : Yumi Shimomura, Yutaka Sugi, Aiko Kume, Wataru Tanaka, Tsutomu Yoshihara, Tetsuya
Matsuura, Yasuhiko Komiya, Yusuke Ogata, Wataru Suda, Masahira Hattori, Takuma
Higurashi, Atsushi Nakajima, Mitsuharu Matsumoto
掲載雑誌:
Microbiology Spectrum
DOI :
https://doi.org/10.1128/spectrum.05123-22
用語説明
*1 菌株:
同一種内の生物個体のことであり、ヒトの場合、各個人に該当する。菌株毎に特徴や能力に差が認められる。
*2 CRISPR-Cas [clustered regularly interspaced short palindromic repeats (CRISPR)およびCRISPR-
associated (Cas)] システム:
ファージやプラスミドに対して原核生物が持つ獲得免疫機構として機能するDNA領域。細菌に侵入したファージやプラスミドに由来する外来性遺伝子の一部を、CRISPR領域に取り込む[繰り返し配列(リピート配列)の間に感染ファージのDNA断片(スペーサー配列)を挟み込む]ことで、獲得免疫系として機能するシステム。菌株によって感染履歴が異なるため、菌株毎にCRISPR関連領域の長さ(サイズ)が異なる(図1参照)。
*3 AP-PCR法:
ゲノム中の繰り返し配列をターゲットにした任意のプライマーを用いて鋳型DNAを増幅させることで、菌株レベルで増幅されるDNA断片のサイズと数に再現性高く差が出ることを利用して菌株を識別する方法。感染性病原菌の菌株特定などに広く利用されている。
*4 ファージ:
細菌や古細菌に感染して増殖するウイルス(バクテリオファージとも呼ばれる)。
参考文献
[1] Tsutomu Yoshihara, Mitomu Kioi, Junichi Baba, Haruki Usuda, Takaomi Kessoku, Michihiro Iwaki, Tomohiro Takatsu, Noboru Misawa, Keiichi Ashikari, Tetsuya Matsuura, Akiko Fuyuki, Hidenori Ohkubo, Mitsuharu Matsumoto, Koichiro Wada, Atsushi Nakajima, Takuma Higurashi.
A prospective interventional trial on the effect of periodontal treatment on Fusobacterium nucleatum abundance in patients with colorectal tumours.
Scientific Reports. 11,23719(2021). doi:
https://doi.org/10.1038/s41598-021-03083-4
[2] Komiya Y, Shimomura Y, Higurashi T, Sugi Y, Arimoto J, Umezawa S, Uchiyama S, Matsumoto M, Nakajima A. Patients with colorectal cancer have identical strains of Fusobacterium nucleatum in their colorectal cancer and oral cavity.
Gut. 2019;68(7):1335-1337. doi:
https://doi.org/10.1136/gutjnl-2018-316661