横浜市立大学大学院生命医科学研究科 構造生物学研究室 畑 圭一さん(2021年度博士前期課程修了)、有田 恭平教授、同研究科 構造エピゲノム研究室 小沼 剛助教、池上 貴久教授、理化学研究所 生命機能科学研究センター 小林 直宏上級研究員らを中心とした研究グループは、DNAメチル化の維持に関与するタンパク質UHRF1
で決定しました。本成果は、卵子形成においてDPPA3がUHRF1の機能を阻害する分子機構を解明し、正常な卵子形成や受精、胚発生の基礎的なメカニズムに関する知見をもたらします。
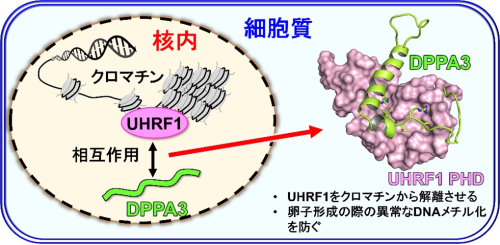
図1 卵母細胞における母性因子DPPA3によるUHRF1の機能阻害のモデル図。UHRF1はDNAメチル化の維持に関与する。
体細胞ではUHRF1は核内で働き、卵母細胞ではDPPA3との結合によりクロマチンから解離し核外に移行する。
これにより卵子形成の際の異常なDNAメチル化が防がれ、正常な卵子形成が起こる。本研究では、DPPA3によるUHRF1の機能阻害機構を
構造生物学的な研究で解明した。
研究背景
ヒトの体は約37兆個もの細胞で構成され、その種類は筋肉細胞、神経細胞、血液細胞など約270にも及ぶといわれています。たとえば、血液細胞のひとつである白血球としての構造と機能を個々の細胞に持たせるためには、それに相当する遺伝子の発現が必要になります。この遺伝子の発現を制御しているのがDNAメチル化であり、DNAメチル化パターンの違いによって様々な細胞の種類が決まっています。すなわち、DNAメチル化がヒトの生涯を通して維持されることで、細胞はその働きや形を保ったまま正常に増殖することができます。これをDNA維持メチル化といいます。UHRF1はDNAメチル化酵素DNMT1と協調して働き、細胞のDNAメチル化状態の維持を制御します。
近年、卵子形成において、初期胚、始原生殖細胞、卵細胞で特異的に発現する母性因子DPPA3(Developmental Pluripotency Associated 3, 別名Stella, PGC7)がUHRF1の機能を阻害することが報告されました(Li et al., Nature 2018)。DPPA3は、卵子形成の過程でUHRF1に結合し、UHRF1をクロマチン
*4から引き剥がして核外に輸送することがわかりました。DPPA3遺伝子をノックアウトしたマウスの卵母細胞では、UHRF1は核内に局在し、DNMT1と共に異常なDNAメチル化を起こします。その結果、卵母細胞は正常な機能を維持できず、その後の受精卵は最初の細胞分裂後である2細胞期までに死に至ります。従って、卵母細胞におけるUHRF1とDPPA3の相互作用が、正常な卵子形成とその後の胚発生、つまり生命の誕生に必須です。しかし、卵子形成の過程でDPPA3がUHRF1のクロマチン結合をどのように阻害して、その働きを阻害しているかは不明であったため、その相互作用メカニズムの解明が望まれていました。また、DPPA3は天然変性タンパク質
*5であり、その構造柔軟性が複合体構造決定のボトルネックとなっていました。そこで本研究グループは、UHRF1とDPPA3の複合体の立体構造を溶液NMR法で決定しました。得られた立体構造からDPPA3が大きな構造変化を伴って、UHRF1の多数の分子表面と相互作用していることを明らかにし、この相互作用がUHRF1の機能を阻害する分子基盤であることがわかりました。
研究内容
【相互作用領域の同定】
DPPA3がUHRF1と相互作用するための必要最小限領域の同定を生化学的な研究手法で解明しました。UHRF1はアミノ末端からUBL, TTD, PHD, SRA, RINGの5つのドメインから構成されています。そのうち、ヒストンH3
*6や複製因子PAF15
*7と相互作用するPHDドメイン(302-372アミノ酸残基、以下UHRF1 PHD)がDPPA3との相互作用を担う領域であることがわかりました。一方で、DPPA3は150アミノ酸残基から成りますが、全体に渡って特定の立体構造をとらない天然変性タンパク質として知られています。DPPA3のカルボキシ末端領域の76-127アミノ酸残基(以下DPPA3c)がUHRF1 PHDとの相互作用に必須であることがわかりました。
【溶液NMRによる構造決定】
天然変性タンパク質であるDPPA3の構造柔軟性や複合体の分子量の低さ(約14,000)を考慮し、溶液NMR法によるUHRF1 PHDとDPPA3cの複合体について構造決定を試みました。さらにNMR信号を効率的に解析するため、UHRF1 PHDのカルボキシ末端とDPPA3cのアミノ末端を連結したキメラタンパク質を作成して複合体構造の解析に取り組みました。各種NMR測定には、横浜市立大学 鶴見キャンパスに設置されているブルカー社製の950 MHzと800 MHz、500 MHzのNMR装置を用いました。これらの高磁場NMR装置使用は、良質なNMRスペクトルの収集に貢献し、本研究成果に必須でした。また、理化学研究所の小林直宏上級研究員が開発したソフトウエアMagROが、従来法では半年以上を要するNMRスペクトルの解析を2か月ほどに短縮し、構造決定に重要な役割を果たしました。
【UHRF1 PHDとDPPA3cの複合体構造】
UHRF1 PHDはpre-PHDとcore-PHDの2つの領域から成る構造をしています。UHRF1 PHDへの結合に伴ってDPPA3cに特徴的な構造誘起が起こることがわかりました。DPPA3cは中央領域で短いαヘリックス構造
*8を形成し、その直後に‘L字’の形をとるように約90度曲がり、長いαヘリックスを形成します(図1)。この長いαヘリックスが、pre-PHDとcore-PHDの間の溝に入り込んでUHRF1 PHDと結合していました(図1)。短いαヘリックスのアミノ末端側にあるVRT(バリン―アルギニン―スレオニン)配列はUHRF1 PHDのcore-PHDと相互作用していました。これまでの研究から、UHRF1 PHDはヒストンH3のアミノ末端のART(アラニン―アルギニン―スレオニン)配列や、PAF15のアミノ末端のVRT(バリン―アルギニン―スレオニン)配列と結合することが知られていました。一方でDPPA3は、88-90番目のアミノ酸残基のVRT配列に加えて、短いαヘリックスと長いαヘリックスも使ってUHRF1 PHDと相互作用します。この広い相互作用面によって、DPPA3はUHRF1 PHDにヒストンH3やPAF15よりも70倍も強い親和性で結合することがわかりました。UHRF1のクロマチンへの局在は、PHDドメインによるヒストンH3への結合が重要です。DPPA3はヒストンH3よりも強い親和性でUHRF1と結合できます。従って、DPPA3はUHRF1とヒストンH3の結合を競合的に阻害することで、UHRF1をクロマチンから解離させその機能を阻害すると考えられます。
【アフリカツメガエル卵抽出液やマウスES細胞を用いた機能解析】
DPPA3とUHRF1 PHDの相互作用の機能的な重要性を確認するため、相互作用界面に位置するアミノ酸残基に変異を導入した変異体DPPA3を作成して、アフリカツメガエルの卵抽出液やマウスES細胞を用いた解析を行いました(東京大学 中西真 教授、西山敦哉 准教授、ミュンヘン大学 Heinrich Leonhardt教授との共同研究)。
まず、UHRF1 PHDとの相互作用面に存在するDPPA3のVRT配列、短いα-ヘリックスや長いα-ヘリックス中のアミノ酸残基に変異を導入したDPPA3は、UHRF1 PHDとの結合が弱くなる、または消失することを試験管内で確認しました。さらに、ツメガエル抽出液を用いた実験から、これら変異体DPPA3はUHRF1のクロマチンへの局在を抑制できないことがわかりました。最後にツメガエル抽出液とマウスES細胞を用いてDNAメチル化解析を行いました。野生型DPPA3はUHRF1をクロマチンから解離させるので、ゲノムDNAの脱メチル化が起こります。しかし、変異体DPPA3ではDNAの脱メチル化を起こせないことがわかりました。これらのことから、構造生物学的に同定したUHRF1とDPPA3の相互作用が、細胞内におけるUHRF1の機能阻害(クロマチン局在の阻害)に必須であることがわかりました。
今後の展開
本研究では、卵子形成に必須なUHRF1とDPPA3の相互作用メカニズムについて、溶液NMR法を用いた構造生物学的な観点から解明しました。この成果からは、正常な卵子形成や受精、胚発生に関する基礎生物学的な分子メカニズムの知見を得ることが期待できます。また、興味深いことに、UHRF1 PHDのpre-PHDとcore-PHDの間の溝がDPPA3との相互作用に使われていることが明らかになりました。この溝はUHRF1 PHDに結合する他の因子(ヒストンH3やPAF15) との結合には使われていません。従って、UHRF1 PHDの溝に結合する化合物があれば、DPPA3との結合のみを特異的に阻害できる可能性があります。近年、肝細胞癌で高発現したDPPA3がUHRF1の局在の異常を引き起こすことが報告されています。今後は、UHRF1 PHDの溝を標的にした化合物を探索し、肝細胞癌の薬剤の基盤となる研究への展開が期待できます。
研究費
本研究は、JSPS科研費 新学術領域「多様かつ堅牢な細胞形質を支える非ゲノム情報複製機構(19H05741)」(JSPS科研費: 18H02392, 19H05294, 19H05285, 21H00272)をはじめ、JSTさきがけ、武田科学振興財団(1871140003)、横浜市立大学(学長裁量事業)戦略的研究推進事業などの助成を受けて行われました。
論文情報
タイトル:Structural basis for the unique multifaceted interaction of DPPA3 with the UHRF1 PHD finger
著者:Keiichi Hata
#, Naohiro Kobayashi
#, Keita Sugimura, Weihua Qin, Deis Haxholli, Yoshie Chiba, Sae Yoshimi, Gosuke Hayashi, Hiroki Onoda, Takahisa Ikegami, Christopher B. Mulholland, Atsuya Nishiyama, Makoto Nakanishi, Heinrich Leonhardt, Tsuyoshi Konuma
*, Kyohei Arita
*
#: equal contribution in this work,
*: co-corresponding authors.
掲載雑誌:Nucleic Acids Research
DOI:10.1093/nar/gkac1082
用語説明
*1 UHRF1:
DNAメチル化維持に必須の役割をするタンパク質。片鎖メチル化DNAへの結合や、9番目のリジンがメチル化されたヒストンH3への結合、ヒストンH3や複製因子PAF15のユビキチン化など様々な機能を発揮することで、DNAメチル化パターンの複製を誘導する。がん細胞では過剰発現しており、異常な細胞増殖に関与する。
*2 DPPA3:
母親由来の遺伝子から発現する母性因子であり、卵子形成に重要な働きをする。卵子形成の過程でUHRF1に結合して、クロマチン局在の抑制と異常なDNAメチル化を防ぐ働きをする。
*3 溶液NMR法:
核磁気共鳴(Nuclear Magnetic Resonance, NMR)法は、強い磁場中に置かれた原子核から発せられる信号(NMR信号)を観測し、分子の構造を解析する手法。本研究では溶液中に存在するタンパク質分子を研究対象としていたため、溶液NMR装置を用いた。
*4 クロマチン:
真核生物の細胞核内では、DNAはヒストンタンパク質に巻き付いてヌクレソーム構造を形成する。ヌクレオソームがさらに集まった構造体をクロマチンと呼ぶ。
*5 天然変性タンパク質:
特定の立体構造を形成しないタンパク質の事を天然変性タンパク質と呼び、結合相手の形に合わせて自身の構造を変化させて結合する。DPPA3はUHRF1 PHDに結合する際にα-ヘリックス構造を誘起する。
*6 ヒストンH3:
ヌクレオソームの構成タンパク質。アミノ末端のART(アラニン-アルギニン-スレオニン)のアミノ酸でUHRF1 PHDに結合し、UHRF1のクロマチンへの局在に寄与する。
*7 PAF15:
DNAポリメラーゼを複製鎖に留める役割をするPCNAに結合するDNA複製因子。アミノ末端のVRT(バリン-アルギニン-スレオニン)のアミノ酸でUHRF1 PHDに結合する。
*8 αヘリックス:
タンパク質中の局所的な構造体で、左巻きのらせん状の構造を形成している領域。