当社の連結子会社である富士レビオ・ホールディングス株式会社(代表取締役社長:石川 剛生、本社:東京都新宿区)傘下のFujirebio Diagnostics, Inc.(CEO:Monte Wiltse、所在地:米国ペンシルバニア州マルバーン、以下「FDI」)は、このたび、全自動化学発光酵素免疫測定システム「ルミパルス G1200」で使用する、脳脊髄液中のβ-アミロイド1-42とβ-アミロイド1-40の比率を測定する検査試薬(以下「本試薬」)について、米国食品医薬品局(以下「FDA」)より承認を取得しましたのでお知らせします。本試薬は、アルツハイマー病
※1等による認知機能低下の診断補助を目的として、FDAから承認された初めての体外診断用医薬品となります。
本試薬は、2019年2月にFDAよりBreakthrough Device の指定を受け
※2、2020年12月に承認申請をしていたものです
※3。認知機能低下の症状を有し、アルツハイマー病等が疑われる55歳以上の方を対象に、脳脊髄液中のβ-アミロイド1-42およびβ-アミロイド1-40を測定し、その比率を評価することで、アルツハイマー病の特徴のひとつとされる脳内アミロイドβの蓄積状態の把握の補助として用いられます。FDIは今後、上市準備が整い次第、本試薬の販売を開始する予定です。
富士レビオグループでは、25年以上にわたるアルツハイマー病領域における研究開発の成果を活用し、ルミパルス試薬の開発および体外診断用医薬品としての承認取得を進めています
※4。今後は、アルツハイマー病との関連が指摘されている血液バイオマーカーを測定するルミパルス試薬の開発を日本および欧州の拠点にてさらに加速させてまいります。富士レビオグループは、グローバル戦略の重要な柱として、アルツハイマー病領域における製品ラインアップのさらなる拡充を通じ、同疾患の診療により一層貢献すべく、今後も取り組みを続けてまいります。
※1 現在、米国では、500万人以上がアルツハイマー病に罹患しており、2050年までに1,400万人に増加すると見込まれている
※2 2019 年2 月15 日付リリース:米国FDA によるアミロイドβ42/40 比測定検査のBreakthrough Deviceへの指定について
https://ssl4.eir-parts.net/doc/4544/tdnet/1677526/00.pdf
※3 2020 年12 月2 日付リリース:米国FDA へのアミロイドβ42/40 比検査の承認申請について
https://www.hugp.com/resources/file/pdf/20201202_news.pdf
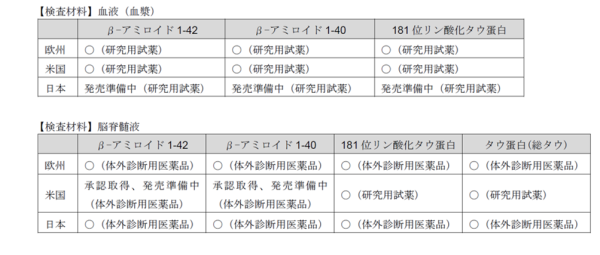
※4 アルツハイマー病領域における各国の関連製品の開発および販売状況は以下の通り
<注意事項>
・本ニュースリリースを含む当社のニュースリリースに記載されている医薬品、医療機器の情報は、
当社の経営情報の開示を目的とするものであり、それぞれが開発中のものを含むいかなる医薬品、
医療機器の宣伝、広告を目的とするものではありません。
・研究用試薬については、ヒト、動物への医療、臨床診断用には使用しないようご注意ください。
以上