Ⅲ. 研究の成果
メガリンは、N末端側の巨大な細胞外領域、単一の膜貫通領域、およびC末端側の短い細胞内領域から成っています。細胞外領域は、約40個のアミノ酸から成るcomplement-type repeat (CR)が4ヶ所にわたって集簇(しゅうぞく)し、いわゆるligand-binding domain(LBD)I–IVを形成しています。さらに、LBDの間にepidermal growth factor(EGF)-type repeatやβ-propellarと呼ばれる構造体が連なっています。今回、本研究グループによって、メガリンの立体構造が解明されたことで、それらの繋がりの意味が明らかになりました。
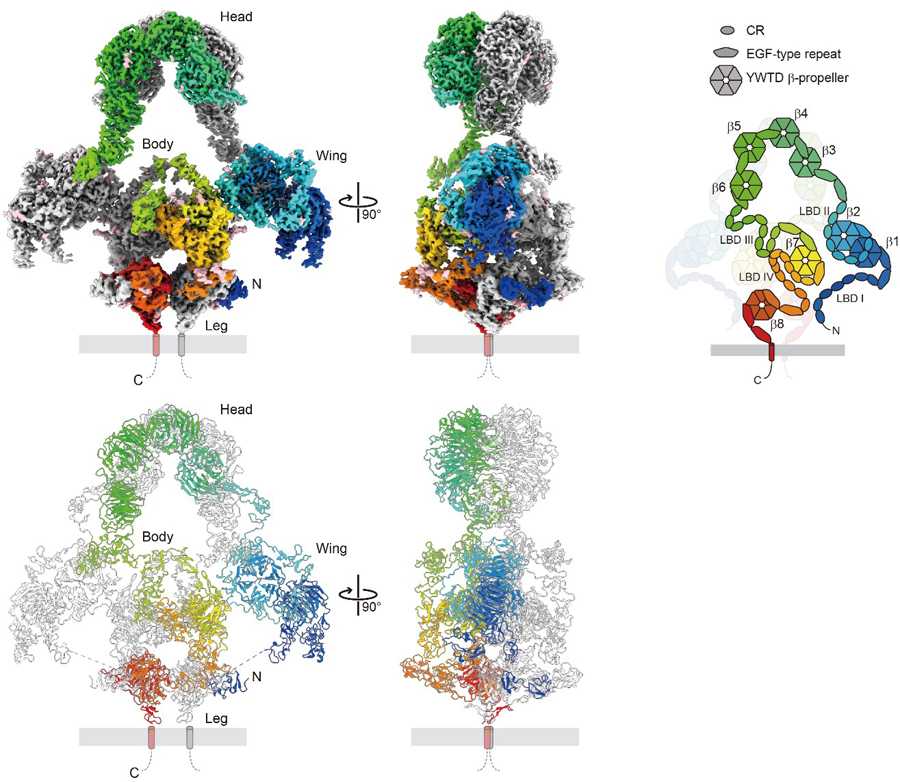 図2 メガリンの全体構造
図2 メガリンの全体構造クライオ電子顕微鏡によって明らかになったメガリンの全体
構造。複数箇所のフォーカスマップを合成した全体の密度マ
ップ(上)、および全体のリボンモデル図(下)を示した。
クライオ電子顕微鏡による解析から、メガリンは二つの分子が背中合わせに結合した二量体構造を形成することが明らかになりました。その全体像はあたかも鳥のような形を呈し、head、wing、body、legの領域に分かれています(図2左)。
さらにクライオ電子顕微鏡による観察から、生体内のリガンド分子がメガリンの複数個所に結合していることが明らかになりました(図3)。これらの結果から、メガリンのLBD、および
β-propellarは協調して、様々な形の結合ポケットを作り出すことで、多様なリガンドを認識していることが明らかになりました。
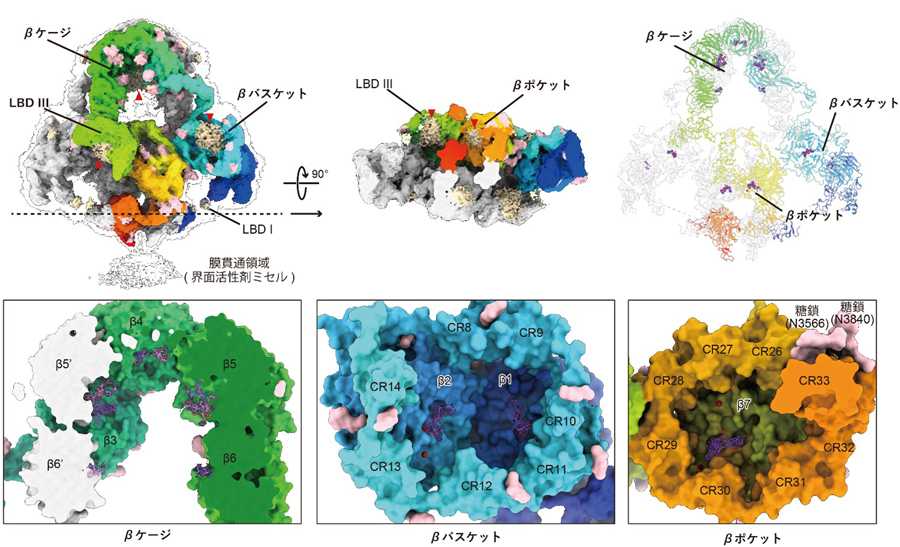 図3 メガリンのリガンド結合部位
図3 メガリンのリガンド結合部位これまでリガンド結合部位だと考えられてきたLBDだけでなく、
β-propellarと協調して様々な結合ポケットを作り出していること
が明らかになった。新たに同定されたリガンド結合部位は、それぞ
れβケージ、βバスケット、βポケットと名付けた。
さらに、メガリンのリガンドの一つで、シャペロン分子としてもはたらくRAPとメガリンの複合体の立体構造に関しても、クライオ電子顕微鏡法による観察によって明らかにしました(図4左)。複合体の構造では、RAPの三つのドメイン(D1~D3)のうち、D1とD3の二つだけがメガリンと相互作用していましたが、分子間相互作用解析法(表面プラズモン共鳴法
(注6))を用いて解析したところ(図4右)、いずれのドメインも単独でメガリンと結合できることがわかりました。これらの結果から、RAPはフレキシブルにメガリンと相互作用を形成して、フォールディングを助けるという仕組みをもつことが明らかになりました。
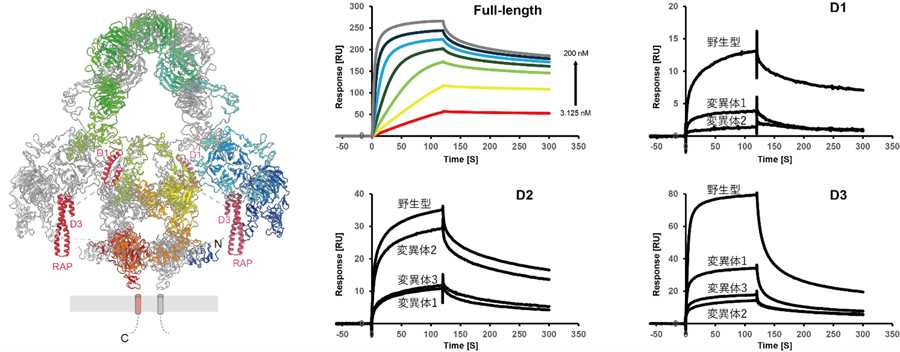 図4 メガリンとRAPの複合体構造
図4 メガリンとRAPの複合体構造クライオ電子顕微鏡によって明らかになったメガリン-RAP複合体の全体構造(左)、および表面プラズモン共鳴
法による相互作用解析(右)。複合体構造においては、RAPの三つのドメイン(D1~D3)のうち、D1とD3のみ
がメガリンと相互作用していたが、相互作用解析によってすべてのドメインが単独で結合しうることが示された。
Ⅳ. 今後の展開
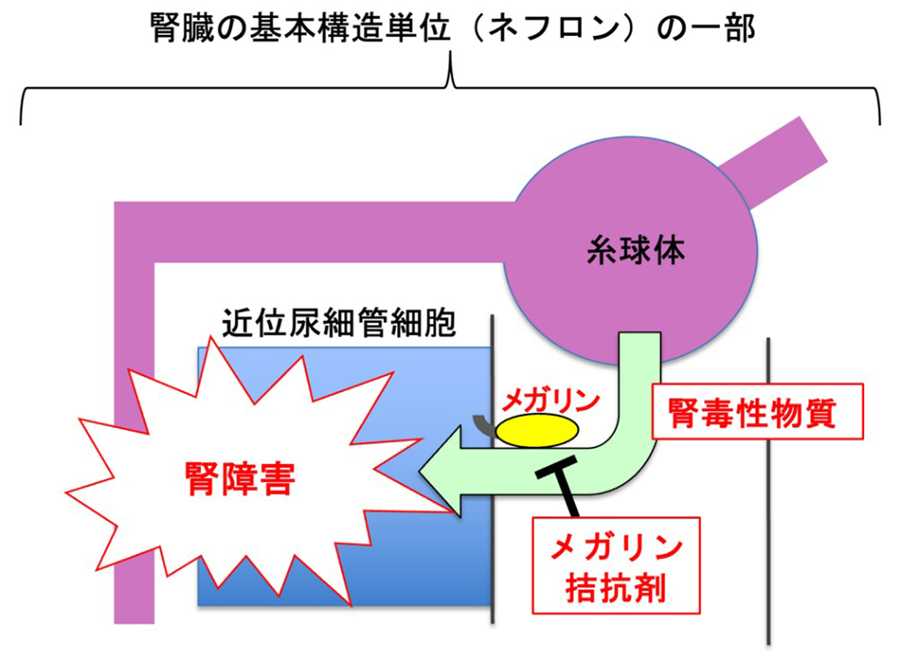
腎臓は、様々な物質を尿中に排泄するとともに、特に近位尿細管細胞において、各種の物質を取り込み、代謝を行なっています。メガリンは、タンパク質・ペプチド・薬剤など、様々な物質の取り込み・代謝に関わる受容体分子であり、腎臓の代謝機能において、中心的な役割を担っています。今回の研究によって、メガリンとリガンドとの相互作用様式・部位が明らかになったことで、腎臓の物質代謝機能を理解するための基本的な仕組みがわかりました。メガリンを介して腎臓に取り込まれ、腎臓病を引き起こす腎毒性物質が多く報告されていますが、今後、メガリン結合を阻害して腎臓病の発症を防ぐような薬剤(メガリン阻害剤)の開発につながることが期待されます。
Ⅴ. 研究成果の公表
本研究成果は、2024年5月21日、科学誌「Proceedings of the National Academy of Sciences of the United States of America(米国科学アカデミー紀要)」(2022年インパクトファクター: 11.1)に掲載されました。
論文タイトル:Cryo-EM structures elucidate the multiligand receptor nature of megalin
著者:Goto S*, Tsutsumi A*, Lee Y, Hosojima M, Kabasawa H, Komochi K, Nagatoishi S, Takemoto K, Tsumoto K, Nishizawa T**, Kikkawa M**, Saito A** (*equal contribution, **correspondence)
doi:https://doi.org/10.1073/pnas.2318859121
Ⅵ. 謝辞
本研究は、文部科学省科学研究費助成事業[JP20H03216、JP23H02439(西澤); JP21H02934(斎藤)]、AMED腎疾患実用化研究事業[JP19ek0310014、JP20ek0310014、JP21ek0310014、JP22ek0310019、JP23ek0310019(代表者:斎藤)]、生命科学・創薬研究支援基盤事業(BINDS)(JP22ama121002、JP22ama121033)の支援を受けて行われました。
【用語解説】
(注1)クライオ電子顕微鏡法
2017年にノーベル化学賞が授与された電子顕微鏡による構造解析の手法。生体試料を急速凍結して氷の中に埋め込んで、高性能の透過型電子顕微鏡で観察し、3次元で多数の投影像から立体構造を再構築することにより、従来のX線構造解析では困難だったタンパク質などの微細な構造解析を行う。
(注2)リガンド
特定の受容体に特異的に結合する物質。
(注3)low-density lipoprotein(LDL)受容体ファミリー
LDL受容体をはじめ、様々な物質の細胞内への取り込みを司り、類似した構造的特徴を有する分子群。
(注4)トランスレーショナルリサーチ
基礎研究の成果を臨床などへ応用(橋渡し)することを目指す研究。
(注5)シャペロン
シャペロン(chaperone)は、あるタンパク質が細胞内で合成された後、正しい過程に従って折りたたまれるのを誘導するタンパク質である。
(注6)表面プラズモン共鳴法
金属センサーの表面に固定化された物質に対して、別の物質が結合・解離する挙動を、金属表面近傍の屈折率変化として非標識かつリアルタイムで計測する方法。結合物質の結合量を測定できるほか、リアルタイム計測結果から結合・解離速度など速度論的解析も行うことができる。