細胞内へのポリアミン輸送メカニズムの解明
1.発表者:
富田 篤弘(東京大学大学院理学系研究科生物科学専攻 博士課程)
大保 貴嗣(旭川医科大学生化学講座 准教授)
草木迫 司(東京大学大学院理学系研究科生物科学専攻 助教)
山下 恵太郎(東京大学大学院理学系研究科生物科学専攻 助教(研究当時)/
MRC分子生物学研究所 博士研究員(現所属))
小笠原 諭(千葉大学大学院理学系研究科基盤理学専攻 特任准教授)
村田 武士(千葉大学大学院理学系研究科基盤理学専攻 教授)
西澤 知宏(東京大学大学院理学系研究科生物科学専攻 准教授(研究当時)/
横浜市立大学大学院生命医科学研究科 生体膜ダイナミクス研究室 教授(現所属))
濡木 理(東京大学大学院理学系研究科生物科学専攻 教授)
2.発表のポイント:
◆リソソーム(注1)内腔から細胞内へとポリアミン(注2)を輸送するATP13A2(注3)の立体構造を解明することに成功しました。
◆ポリアミンを輸送する時のさまざまな状態の立体構造を捕らえ、ポリアミン輸送メカニズムを詳細に解明することに成功しました。
◆ATP13A2の遺伝性変異がパーキンソン病に関与していることから、これらの疾患の理解につながることが期待されます。
3.発表概要:
ポリアミンは、生体内で必須な化合物であり、中でもポリアミンの一種であるスペルミンは、転写の活性化・重金属や活性酸素(注4)からの細胞の保護などの重要な機能を担っています。スペルミンは、エンドサイトーシス(注5)によってリソソーム内腔へ運ばれた後に、P型ATPアーゼ(注6)の1つであるATP13A2によって細胞質側へと取り込まれます。しかし、スペルミンを輸送するATP13A2の基質認識および輸送機構は明らかにされていませんでした。
今回、東京大学大学院理学系研究科の濡木教授らのグループは、ヒトが持つATP13A2の立体構造を、クライオ電子顕微鏡(注7)を用いた単粒子解析法(注8)によって明らかにしました。また、ATP13A2がATPを利用して、スペルミンを輸送する過程を捉えた複数の状態の立体構造を明らかにすることに成功しました。ATP13A2は、リソソーム内腔側に長いトンネル状のポケットをつくりだし、スペルミンはその細長い分子の形状に合わせて広く認識されており、このトンネル状のポケットを沿って輸送されることがわかりました。このような基質の認識・輸送機構は新規な知見であり、ATP13A2の変異による疾患のさらなる理解につながると期待されます。
本研究成果は日本時間11月19日(金)午前1時に米国科学雑誌 Molecular Cellでオンライン公開されました。
4.発表内容:
ポリアミンは、生体内で必須な化合物であり、中でもポリアミンの一種であるスペルミンは、転写の活性化・重金属や活性酸素からの細胞の保護などの重要な機能を担っています。細胞内のスペルミンは、生合成経路と細胞外からの取り込み経路から供給されます。しかし、スペルミンの生合成量は加齢とともに減少するため、長期的な細胞内のスペルミン供給には、細胞外からのスペルミンの取り込みが重要であると考えられています。細胞外からの取り込み経路において、スペルミンはエンドサイトーシスによってリソソーム内腔へ取り込まれた後に、P型ATPアーゼの1つであるATP13A2によって、細胞質側へと取り込まれます(図1)。ATP13A2は、PARK9という名前でも知られており、パーキンソン病の原因遺伝子の一つとされています。したがって、その基質認識・輸送機構を理解することは、ATP13A2の遺伝性変異に由来するパーキンソン病の理解・治療方法の確立につながると期待されます。
P型ATPアーゼは、これまでに筋小胞体Ca2+ポンプ(SERCA)やNa+/K+‐ATPアーゼなどの金属イオンを基質として輸送するP2-ATPアーゼや、脂質フリッパーゼであるP4-ATPアーゼの輸送メカニズムに関しては詳細に研究がされてきました。しかし、大きな親水性分子であるスペルミンは、金属イオンや脂質とは化学的な性質が大きく異なるため、ATP13A2がスペルミンを認識して輸送する仕組みは不明なままでした。
今回、東京大学大学院理学系研究科の濡木理教授らの研究グループは、クライオ電子顕微鏡を用いた単粒子解析法を用いて、スペルミン結合状態のヒト由来のATP13A2の立体構造を決定しました(図2)。
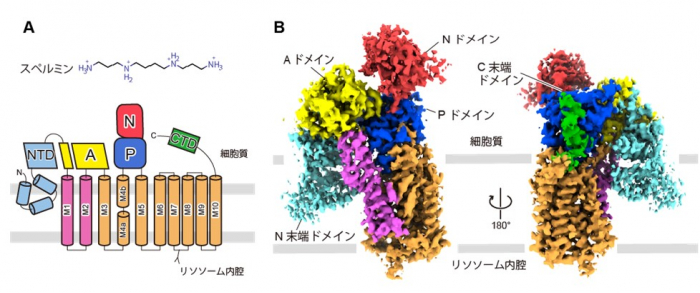
得られた立体構造から、ATP13A2はP型ATPアーゼ構造を示し、3つの細胞質ドメイン(A:アクチュエータドメイン、N:ヌクレオチド結合ドメイン、P:リン酸化ドメイン)と10本の膜貫通ヘリックス(M1~10)から構成されていました。加えて、ATP13A2は他のP型ATPアーゼには保存されていない特徴的なN末端ドメインとC末端ドメインを有していました。
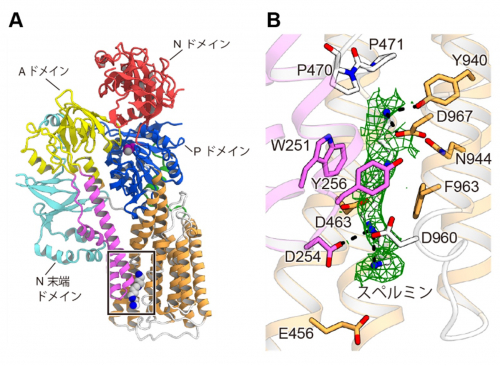
得られた立体構造中で、スペルミンはM1-M6の膜貫通ヘリックスからなる基質結合ポケットに結合していました(図3)。基質結合ポケットは、酸性アミノ酸と芳香族アミノ酸から構成されたトンネル型の形状をしており、酸性アミノ酸による静電相互作用および芳香族アミノ酸によるπ-カチオン相互作用(注9)で、スペルミンの正に帯電したアミノ基を広く認識していました。このような大きな基質結合ポケットからなる認識様式は、小さな金属イオンや脂質を基質とする他のP型ATPアーゼには見られない特徴的なもので、スペルミンの認識に重要であることがわかりました。
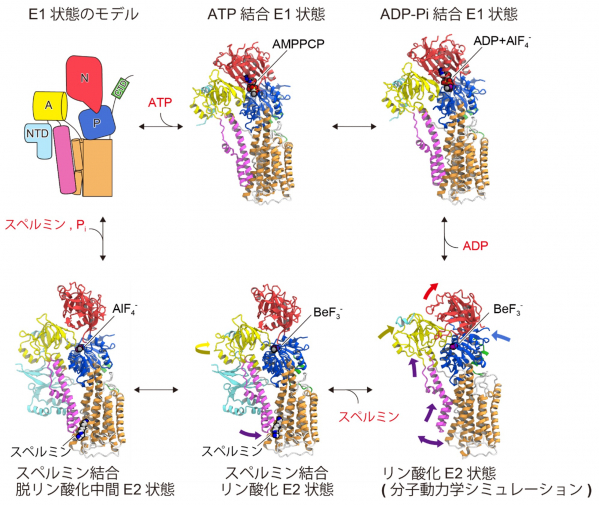
さらに、ATP結合状態を模倣するATPアナログ(AMPPCP)、リン酸化状態を模倣するアルミニウムフロライド(AlF4-)やベリリウムフロライド(BeF3-)を用いて明らかになった複数の中間体の立体構造と分子動力学シミュレーション(注10)を組み合わせることで、ATP13A2のスペルミンの輸送機構を解明することに成功しました(図4)。
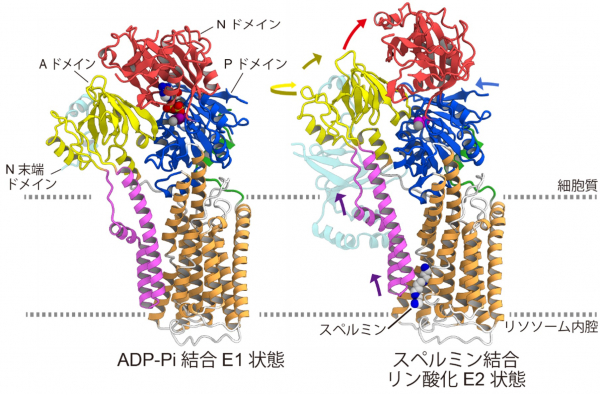
ATP13A2は、リン酸化された状態ではM1およびM2ヘリックスが大きく細胞質側へスライドすることでスペルミン結合ポケットを形成して、そこにスペルミンが結合することがわかりました(図4, 5)。さらに、スペルミンが結合することで、脱リン酸化を促進する構造にATP13A2を固定することがわかりました。以上から、スペルミンの結合によって脱リン酸化反応が促進されて、リン酸の脱離に伴ってスペルミンが細胞質側へと輸送されるという輸送機構が提唱されました。このようなスペルミンの輸送は、新規な機構であり、ATP13A2の変異が原因となるパーキンソン病のさらなる理解につながると期待されます。
本研究は、日本学術振興会における科学研究費助成事業の特別推進研究「物理刺激で制御される膜蛋白質の分子機構の解明」(研究課題:16H06294 研究開発代表者:濡木理)の一環で行われました。また、本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」の一環として、クライオ電子顕微鏡などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」の支援により行われました。
5.発表雑誌:
雑誌名:「Molecular Cell (11月19日オンライン公開)」
論文タイトル:Cryo-EM reveals Mechanistic Insights into Lipid-facilitated
Polyamine Export by Human ATP13A2
著者:Atsuhiro Tomita, Takashi Daiho, Tsukasa Kusakizako, Keitaro Yamashita, Satoshi Ogasawara, Takeshi Murata, Tomohiro Nishizawa* & Osamu Nureki*
DOI番号:10.1016/j.molcel.2021.11.001
アブストラクトURL:https://doi.org/10.1016/j.molcel.2021.11.001
6.用語解説:
(注1)リソソーム
細胞内小器官の一種で、細胞内外の物質を蓄積して分解する機能がある。
(注2)ポリアミン
第一級アミノ基を2つ以上もつ直鎖脂肪族炭化水素の総称。規則的に配置される正に帯電したアミノ基がタンパク質や核酸、金属イオンなどの化学物質と相互作用することで生理的な機能を果たす。代表的なポリアミンとしてスペルミンやスペルミジン、プトレッシンなどが知られている。
(注3)ATP13A2
P型ATPアーゼの一つであり、パーキンソン病の原因遺伝子の一つであることからPARK9という名前でも知られている。ATPの加水分解と共役して基質を運ぶと考えられていたが、長年その輸送基質は不明であった。2020年にスペルミンなどのポリアミンを基質として輸送する事が報告された。
(注4)活性酸素
酸素分子に由来する反応性に富む分子群の総称で、ミトコンドリアの電子伝達系の副産物などから生産される。生体内に存在する活性酸素は様々な物質に対して非特異的な化学反応を起こすため、生体にとって有害であることが知られている。
(注5)エンドサイトーシス
食作用や飲作用を通して細胞が細胞外から物質を取り込む過程のこと。最終的に物質が細胞質側へと取り込まれるためには、膜輸送タンパク質によって生体膜を横切る輸送が行われる必要がある。
(注6)P型ATPアーゼ
ATPアーゼの分類の一つで、酵素活性に関わるアスパラギン酸がATPの加水分解の過程でリン酸化された中間体を生じるもの。P型ATPアーゼによる物質輸送は、ATP加水分解に共役したATPアーゼドメイン内のアスパラギン酸のリン酸化と脱リン酸化が、基質に対して異なる親和性をもつ2つの中間状態(E1とE2)の間の遷移を仲介することで、生体膜を横切る基質輸送を可能にする。
(注7)クライオ電子顕微鏡
液体窒素(-196℃)冷却下でタンパク質などの生体分子に対して電子線を照射し、試料の観察を行うための装置。タンパク質の立体構造を高分解能で決定する手法として、検出器などにおいて目覚ましい技術革新を遂げており、2017年に、その開発に貢献した海外の研究者三名にノーベル化学賞が贈られた。
(注8)単粒子解析法
電子顕微鏡を用いて撮影した多数の生体高分子の像からタンパク質の立体構造を再構成することで、タンパク質などの生体高分子の立体構造を決定する手法。
(注9)π-カチオン相互作用
電子を豊富に持つπ電子系と近接するカチオンとの間に働く非共有結合性の分子間相互作用であり、水素結合や塩橋と同程度の強さの相互作用を示す。生体内においてはπ電子系を持つトリプトファンやチロシンなどの芳香族アミノ酸と正電荷を持つ金属イオンやアミノ基との間にπ-カチオン相互作用が働き、基質認識や高次構造の形成に寄与することが知られている。
(注10)分子動力学シミュレーション
多数の原子・分子を含む系について、古典力学におけるニュートン方程式を解くことで、その系の動的過程(ダイナミクス)を解析する手法。タンパク質の構造に適用することで、その構造が水溶液中あるいは細胞膜中でどのように変化するかを調べることが可能となる。
7.添付資料:
図1: ATP13A2による細胞内へのスペルミン取り込み
図2:スペルミンの化学構造とATP13A2のトポロジー図 (A) とクライオ電子顕微鏡構造 (B)
図3:スペルミンの認識
(A)スペルミン結合状態のATP13A2の立体構造。スペルミン結合部位を四角で示す。(B) スペルミン結合部位の拡大図。結合したスペルミン由来の密度マップを緑色で示す。スペルミンの認識に関わるアミノ酸残基を示す。
図4:ATP13A2のスペルミン輸送サイクル
ATP13A2の中間体の立体構造をスペルミン輸送サイクル中で示す。
図5:ADP-Pi結合E1状態とスペルミン結合リン酸化E2状態の構造比較
- 本件に関するお問合わせ先
-
横浜市立大学 広報課
E-mail:koho@yokohama-cu.ac.jp