〜より安全な免疫抑制剤による薬物療法の開発に期待〜
免疫抑制剤のミコフェノール酸モフェチルは臓器移植後の拒絶反応の予防やループス腎炎の治療に用いられる薬です。ミコフェノール酸モフェチルを服用すると、体内に吸収された後、薬効を示すミコフェノール酸に変換され血液を介して全身を巡ります。血液中ではミコフェノール酸の97–99%が血漿タンパク質(特にヒト血清アルブミン)に結合していることが知られています。しかし、腎機能が低下すると、ミコフェノール酸のヒト血清アルブミンへの結合率も低下することが知られていて、これが原因となってミコフェノール酸の副作用へと繋がってしまうことが懸念されています。藤田医科大学 医学部 微生物学講座 河合 聡人 講師は、崇城大学 薬学部 薬物動態学研究室 山崎 啓之 教授らとの共同研究でミコフェノール酸とヒト血清アルブミンとの相互作用解析を行い、ミコフェノール酸のヒト血清アルブミン中での正確な結合位置を解明しました。そして、腎機能の低下に伴い蓄積される尿毒症物質の中でも特に3-carboxy-4-methyl-5-propyl-2-furanpropionate(CMPF)がミコフェノール酸とヒト血清アルブミンの結合を邪魔することを実験的に証明しました。これらの成果は、腎機能を考慮したミコフェノール酸の最適な薬物投与設計研究に応用され、腎臓の機能が低下した患者さんであってもより安全にミコフェノール酸を服用できるようになることが期待されます。
本研究成果は、アメリカ化学会が出版している学術ジャーナル「Journal of Medicinal Chemistry」(オンライン版2022年12月20日公開)で発表されました。
<研究成果のポイント>
- ミコフェノール酸(免疫抑制剤ミコフェノール酸モフェチルの活性体)とヒト血液中に含まれるタンパク質との相互作用解析を行い、ミコフェノール酸がヒト血清アルブミンのサブドメインIIAに結合することを解明した
- X線結晶構造解析法によりミコフェノール酸とヒト血清アルブミンとの複合体の立体構造、正確な結合位置の決定に成功した
- 代表的な尿毒症物質(インドキシル硫酸、インドール酢酸、p-クレジル硫酸、CMPF)や、腎障害時に血液中の量が増加する遊離脂肪酸(オレイン酸、ミリスチン酸)が共存した場合のミコフェノール酸のヒト血清アルブミンに対する結合能の変化について明らかにし、特に尿毒症物質であるCMPFがミコフェノール酸とヒト血清アルブミンの結合を邪魔することを実験的に証明した
<背 景>
ミコフェノール酸はイノシン脱水素酵素と呼ばれる酵素の働きを止めることで、Tリンパ球やBリンパ球といった免疫細胞の増殖を抑え、ヒト免疫システムを弱めることができる薬効成分です。この薬効を利用して、ミコフェノール酸は1990年代初頭から臓器移植後の拒絶反応を予防する薬として使用され始めました。加えて、現在の日本では指定難病の1つである全身性エリテマトーデスの合併症として知られるループス腎炎の治療薬としてもミコフェノール酸は利用され、世界に目を向ければ全身性硬化症、炎症性筋疾患などリウマチ性疾患の治療薬としても使用されている薬です。ミコフェノール酸は、ミコフェノール酸モフェチルという飲み薬で処方されます。ミコフェノール酸モフェチルは、ミコフェノール酸よりも消化管からの吸収に優れていて、ミコフェノール酸モフェチルは体内に吸収された後、速やかに薬効を示すミコフェノール酸に変換され血液を介して全身を巡ります。血液中では、ミコフェノール酸は血漿タンパク質、特に含有量が最も多いヒト血清アルブミンと呼ばれるタンパク質に結合した状態が主で、一部のミコフェノール酸がヒト血清アルブミンから外れて存在しています。一般的にこのヒト血清アルブミンから外れたミコフェノール酸が薬効を示し、体の外へ排泄されます。そのため、ミコフェノール酸は少しずつヒト血清アルブミンから外れて薬効を示すと考えられます。このようにヒト血清アルブミンはミコフェノール酸のタンクのような役割を果たしています。しかし、ヒト血清アルブミンに結合する薬はミコフェノール酸だけではなく、抗がん剤や抗菌薬、身近な痛み止めなど多く種類の薬が結合することが知られています。また、ヒトの血液中に元来存在している微量元素やホルモン、遊離脂肪酸などの内因性物質も結合するため、ヒト血清アルブミンに結合する薬の効果は、同じ場所に結合する物質がどの位含まれるのか?という情報が鍵となってきます。つまり、ヒト血清アルブミンの、どの「場所」に、どのような「相互作用」で、どのくらいの「強さ」で結合しているのか?という情報が重要となります。特に腎臓の機能が低下すると、ヒト血清アルブミンも尿と一緒に排泄されてしまい、血液中の割合が減ってしまいます。また、尿毒症物質と呼ばれる物質が血液中に蓄積され、これらがヒト血清アルブミンと結合してしまうため、腎機能が正常な状態とは薬の効果が変わってしまうことが起こります。ミコフェノール酸の血漿タンパク結合も腎臓の機能の影響を大きく受けることは知られていましたが、その詳細なメカニズムは不明でした。
<研究手法・研究成果>
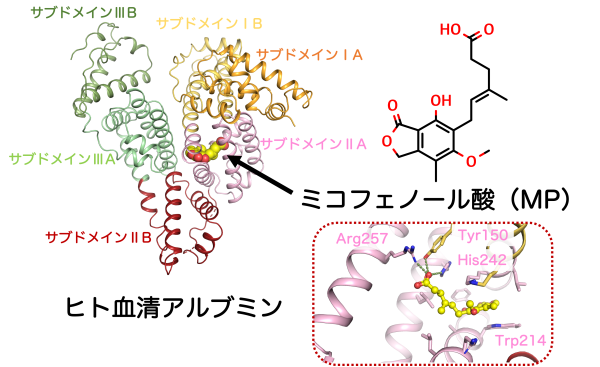
研究グループはまず代表的な血漿タンパク質であるヒト血清アルブミンとα1-酸性糖タンパク質の2種類に対するミコフェノール酸の結合の強さを平衡透析法により調べました。結果、ヒト血清アルブミンへの親和性が1.96×105 M-1、α1-酸性糖タンパク質への親和性が0.12×105 M-1を示し、ヒト血清アルブミンへの結合親和性の方が10倍強いことが明らかになりました。次に、ヒト血清アルブミン中のどの部位に結合しているのかを解明するため、ヒト血清アルブミンのサイトマーカー物質(サブドメインIIA:ワルファリン、アセノクマロール、フェニルブタゾン;サブドメインIIIA:ジアゼパム、アリピプラゾール)を混ぜた時のミコフェノール酸の親和性の変化を計測しました。その結果、サブドメインIIIAのサイトマーカー物質であるジアゼパムやアリピプラゾールが存在している時のミコフェノール酸の親和性は変化しませんでしたが、サブドメインIIAのサイトマーカー物質であるワルファリン、アセノクマロール、フェニルブタゾンが存在すると、その量依存的にミコフェノール酸の親和性が弱くなっていくことがわかりました。これはミコフェノール酸が椅子取りゲームのようにヒト血清アルブミン中で結合部位を取り合っている状態で、ミコフェノール酸はヒト血清アルブミンのドメインIIAに結合することを示しています。さらに視覚的にミコフェノール酸とヒト血清アルブミンの結合状態を観察するため、ヒト血清アルブミンにミコフェノール酸が結合した状態の結晶を調製し、その結晶を用いて茨城県つくば市にある大型放射光実験施設 高エネルギー加速器研究機構Photon FactoryでX線回折データを収集し、ヒト血清アルブミンとミコフェノール酸複合体の立体構造を解明しました。この立体構造でもミコフェノール酸はヒト血清アルブミンのサブドメインIIAに1分子結合している様子が観察されました。さらに、ミコフェノール酸のイソベンゾフラン環がヒト血清アルブミンのTrp214とスタッキング相互作用し、ミコフェノール酸のカルボキシ基はヒト血清アルブミンのTyr150、His242、Arg257と水素結合を形成できる距離に存在していることが明らかになりました(図1)。最後に、腎機能の低下に伴い血液中に蓄積されることが知られている尿毒症物質(インドキシル硫酸、インドール酢酸、p-クレジル硫酸、CMPF)や脂肪酸(オレイン酸、ミリスチン酸)が共存した時のミコフェノール酸のヒト血清アルブミンに対する結合能の変化を調べました。その結果、CMPFが存在すると、ミコフェノール酸のヒト血清アルブミンへの結合能が著しく低下することが示されました。その次に影響が観察されたのは脂肪酸で、脂肪酸はその量が増えてくるとCMPF同様に結合能の低下を引き起こすことが明らかになりました。この結果を踏まえ、ヒト血清アルブミンにミコフェノール酸が結合している構造とCMPFが結合している構造を重ね合わせてみると、両者の結合位置がぴったりと一致していることがわかり、両者が存在するとヒト血清アルブミン中での結合ポケットの取り合いをしていることが視覚的にも想定されました(図2)。
図1 ミコフェノール酸のヒト血清アルブミンでの結合位置
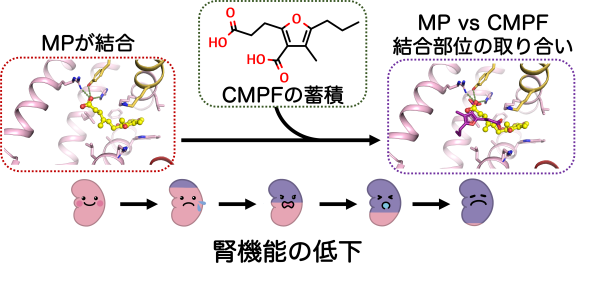
図2 ミコフェノール酸(MP)は腎機能の低下により蓄積する尿毒症物質CMPFによって
ヒト血清アルブミンから追い出されてしまう。
<今後の展開>
本研究を通してミコフェノール酸のヒト血清アルブミンへの結合位置、その相互作用様式、そして結合の強さがわかりました。そして、尿毒症物質であるCMPFがミコフェノール酸のヒト血清アルブミンへの結合を優位に邪魔することが明らかになりました。これまでの研究でCMPFはヒト血清アルブミンのドメインIIAに結合し、その親和性は130.5×105 M-1であることが示されていて、ミコフェノール酸の約70倍強いことが知られています。つまり、このCMPFの血液中の濃度を指標にミコフェノール酸モフェチルの使用量を調節すれば、より安全に治療できることが期待されます。また、研究グループはミコフェノール酸の本来の標的であるイノシン脱水素酵素とミコフェノール酸の立体構造、今回解明したヒト血清アルブミンとミコフェノール酸の立体構造を見比べて、イノシン脱水素酵素の働きを止める作用には影響がなく、CMPFなどのヒト血清アルブミンのドメインIIAに結合する物質との椅子取りゲームに強くなる化合物のデザインを論文中に提案していて、今後、この化合物が想定通りの効果を示すか検証することで、より安全な免疫抑制剤の開発へと繋がることも期待されます。
<文献情報>
●論文タイトル
Structural Basis of the Change in the Interaction Between Mycophenolic Acid and Subdomain IIA of Human Serum Albumin During Renal Failure
●著者
Keishi Yamasaki1,2, Honoka Teshima1, Reina Yukizawa1, Koki Kuyama1, Kenji Tsukigawa1,2, Koji Nishi1,2, Masaki Otagiri1,2, Akito Kawai3
●所属
1. 崇城大学薬学部 2. 崇城大学DDS研究所 3. 藤田医科大学医学部
●責任著者
山崎 啓之(崇城大学)、河合 聡人(藤田医科大学)
●DOI
10.1021/acs.jmedchem.2c01790