コムギの光合成は2段階の葉緑体発生過程を経て成立する
-葉の成長過程における詳細な遺伝子発現マップを作成-
理化学研究所(理研)環境資源科学研究センターバイオ生産情報研究チームの持田恵一チームリーダー(横浜市立大学大学院客員教授)、高萩航太郎大学院生リサーチ・アソシエイト(研究当時、横浜市立大学大学院生命ナノシステム科学研究科)、ロンドン大学ロイヤル・ホロウェイ校のエンリケ・ロペス准教授らの国際共同研究チーム ※ は、パンコムギ(コムギ)の葉の発生過程について詳しく調べ、コムギの光合成機能は、2段階の葉緑体発生過程(色素体 [1] 増殖期と葉緑体成長期)を経て成立することを明らかにしました。 [2] とその内部で発達する葉緑体の状態から、コムギの葉の発生過程を15段階に分類しました。そして、各発生段階の葉組織について、葉緑体の分化と発達、細胞分裂の周期、タンパク質・遺伝子発現などの観点から調査しました。これらのデータを統合して、各発生段階を特徴付けるとともに、コムギの葉の発生に関してはこれまでで最も網羅的かつ詳細な遺伝子発現マップを作成しました。さらに、各発生段階において特徴的な細胞学的な変化と遺伝子発現状態から、コムギの葉における光合成機能が2段階の葉緑体の発生過程を経て成立することを明らかにしました。
※国際共同研究チーム 研究支援 1.背景 [3] から葉の原基組織が発生し先端に向かって成熟する過程における、葉緑体の発生過程と遺伝子発現の関係の全体像は未解明でした。
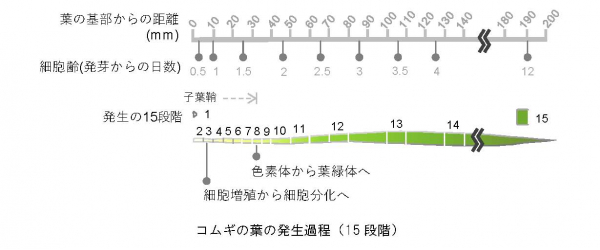
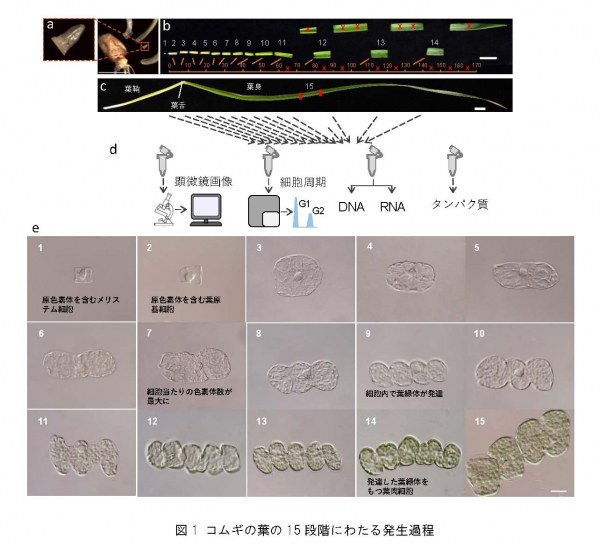
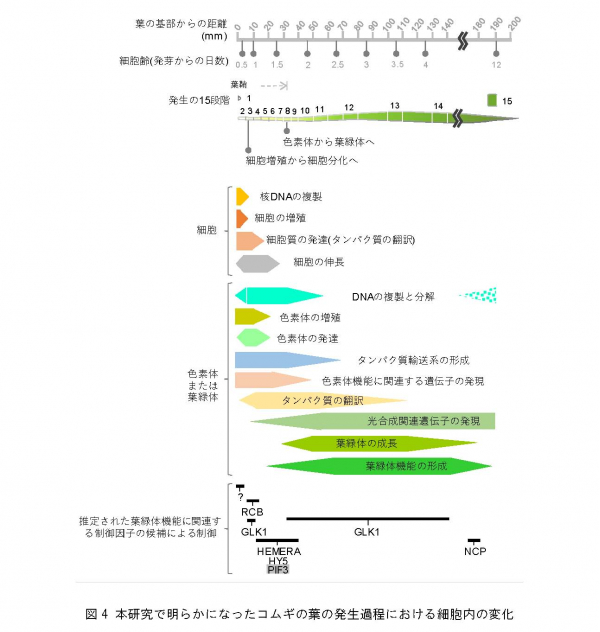
2.研究手法と成果 [4] を持つ未分化な細胞や葉原基細胞が存在しています。また、先端部に向かうにつれて細胞内の色素体や葉緑体の数や大きさが変わり、成熟した葉肉細胞へと変化していきます。そこで、コムギの葉の基部から先端部における細胞について、その形態とともに原色素体や葉緑体の数や大きさを定量し、葉の発生過程を15段階(ステージ)に分類・定義しました(図1)。
a) 発芽6日後の葉の基部から取り出した茎頂組織のサンプル。スケールバーは5mm。
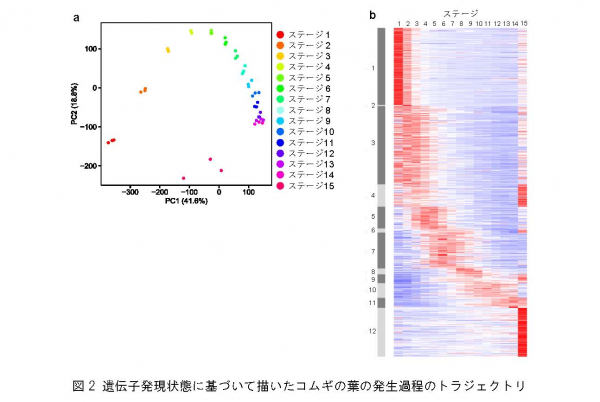
各段階の組織について、細胞や葉緑体の形態を調べるための顕微鏡画像、および葉緑体ゲノムのコピー数の変化を調べるための組織サンプルを収集するとともに、遺伝子の働きを調べるためのRNAやタンパク質を抽出し、葉肉細胞の発生過程のどの段階でどのような変化が細胞内で起きているかを詳細に調査するための試料を整備しました(図1d)。 [5] により解析し、コムギゲノム上に見いだされた10万個あまりの遺伝子のうち、葉の発生段階で発現変動を示す約4万個の発現時期と発現量を明らかにしました。そしてこれらの遺伝子の発現や生物的機能が、葉肉細胞の分化と発達に沿って移り変わる軌跡(発生過程のトラジェクトリ [6] )を初めて可視化しました(図2)。
a) コムギの葉の発生過程で発現が変動する約4万個の遺伝子の発現データを主成分分析することによって、各段階(ステージ)のサンプルの類似性を描画した、遺伝子発現から見た発生過程のトラジェクトリ。それぞれの点が、一つのサンプルに対応し、横軸は第一主成分軸、縦軸は第二主成分軸を示す主成分分析の結果で、距離が近い点ほどサンプル間での遺伝子発現が類似していると考えられる。
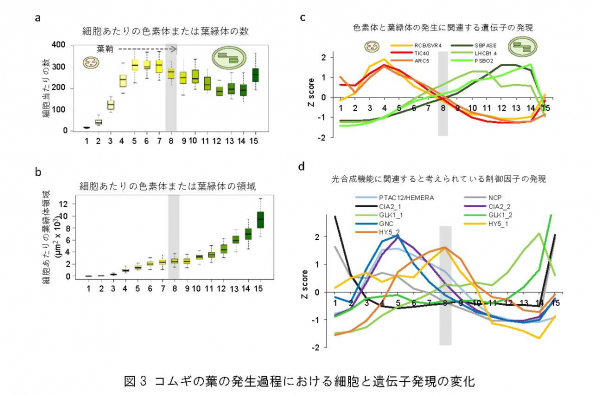
次に、各段階の組織について、細胞周期、細胞の大きさ、細胞当たりの色素体または葉緑体の数、細胞当たりの色素体または葉緑体の占める面積、色素体または葉緑体のゲノムDNA量、色素体または葉緑体リボソーム [7] と細胞質リボソーム量の比などの量的な変化を調査しました。これらの調査結果を統合して解析した結果、葉肉細胞が成熟して光合成が成立するまでの過程は2段階に分かれることが明らかになりました(図3)。
a-b) aは各ステージの細胞の画像解析から定量した細胞当たりの色素体または葉緑体の数の変化。bは細胞内に占める色素体または葉緑体の面積。色素体はステージ1から5にかけて細胞内で増加し、ステージ7まででほぼ最大化し、ステージ8以降、葉緑体に発達することが分かった。
3.今後の期待 [8] 」のうち「2.飢餓をゼロに」および「15.陸の豊かさも守ろう」への貢献が期待できる成果といえます。
コムギの葉の発生過程を15段階 に沿って、細胞レベル・色素体または葉緑体レベル・遺伝子発現レベルの変化を示した。
4.論文情報 5.補足説明
本件に関するお問合わせ先
横浜市立大学 広報課