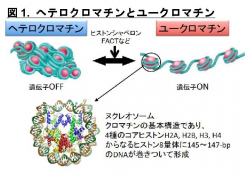
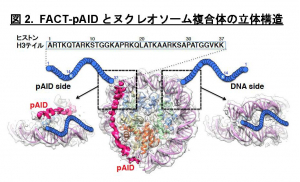
本研究では、ヌクレオソーム中のDNAがFACTのpAID領域と一部置換された複合体のヒストンH3テイルを本学の高磁場NMR分光器を用いて解析し、H3テイルの各々のアミノ酸残基が二つの分離したNMRシグナルとして観察されること発見しました (図3青)。これは同様の電子顕微鏡構造では全く可視化できなかったヒストンH3テイルが二つの異なる動的構造をとることを示しています。これら二つの動的構造は、FACTとヌクレオソームの複合体の非対称な電子顕微鏡構造を反映しており、一方はヒストンテイルが通常のヌクレオソームと同じ二つのDNAによって囲まれた配置(DNA side)、もう一方はpAID蛋白質とDNAによって挟まれた配置(pAID side)と考えられます(図2)。この考察と一致して、二つのNMRシグナルの一方は、対称的な構造をとる通常のヌクレオソームのH3テイルのシグナル(図3赤)とほとんど重なったため、DNA sideのH3 テイルに対応します。
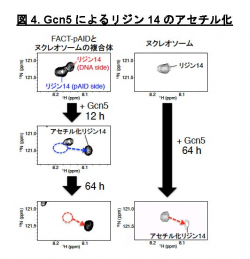
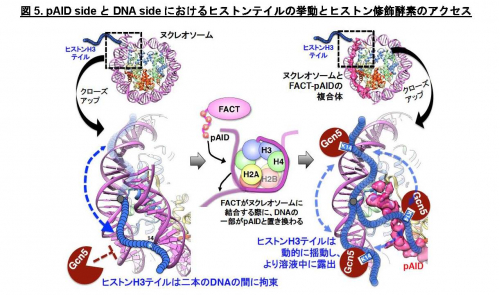
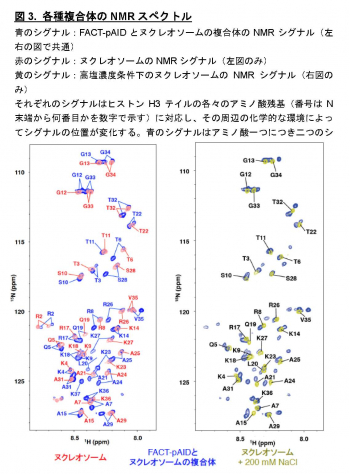 一方、もう片方のシグナルは通常のヌクレオソームを高塩濃度(200 mM NaCl)の条件下で観察した場合のNMRシグナル(図3黄)とほぼ重なります。これは、このpAID sideに対応するH3テイルが、高塩濃度によってDNAとの相互作用が弱められた状態と同様に、DNAから解放されたより動的な構造を取っていることを示します。これらの結果と合致して、 pAID sideのH3テイルは、DNA sideやヌクレオソームのH3テイルに比べて、Gcn5というヒストンアセチル化酵素によるH3の14番目のリシン残基のアセチル化の速度が早くなることも見出しました(図4)。つまり、pAID sideのH3 Nテイルは動的にDNAやpAIDと相互作用しながら、より溶液中に露出しており、ヒストン修飾酵素などの影響を受けやすいのに対して、DNA sideや通常のヌクレオソームのH3テイルはヌクレオソームの二本のDNAに囲まれた構造スペースにその相互作用により拘束されていて、ヒストン修飾酵素のアクセスを強く阻害することがわかりました (図5)。
一方、もう片方のシグナルは通常のヌクレオソームを高塩濃度(200 mM NaCl)の条件下で観察した場合のNMRシグナル(図3黄)とほぼ重なります。これは、このpAID sideに対応するH3テイルが、高塩濃度によってDNAとの相互作用が弱められた状態と同様に、DNAから解放されたより動的な構造を取っていることを示します。これらの結果と合致して、 pAID sideのH3テイルは、DNA sideやヌクレオソームのH3テイルに比べて、Gcn5というヒストンアセチル化酵素によるH3の14番目のリシン残基のアセチル化の速度が早くなることも見出しました(図4)。つまり、pAID sideのH3 Nテイルは動的にDNAやpAIDと相互作用しながら、より溶液中に露出しており、ヒストン修飾酵素などの影響を受けやすいのに対して、DNA sideや通常のヌクレオソームのH3テイルはヌクレオソームの二本のDNAに囲まれた構造スペースにその相互作用により拘束されていて、ヒストン修飾酵素のアクセスを強く阻害することがわかりました (図5)。